
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЭЛЕКТРОЛИЗ. Цель работы: опытным путем изучить электролиз растворов солей
|
|
|
|
Цель работы: опытным путем изучить электролиз растворов солей.
Теоретическая часть.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах, при прохождении электрического тока через раствор или расплав электролита. Это не самопроизвольный процесс, для осуществления химической реакции требуется электрическая энергия. Сущность электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде - процесс окисления. Процессы, протекающие на электродах, зависят как от электролита, так и от вещества, из которого сделан анод.
Различают два вида анодов: растворимые и нерастворимые.
Нерастворимый, или инертный, анод не изменяется в процессе электролиза, играет роль передатчика электронов (графит, уголь, платина и др.).
Растворимый или активный анод в процессе электролиза окисляется (м едь, железо, кобальт и др.): Мео -nē =Мen+
На электродах легче всего протекают процессы, требующие минимальной затраты энергии.
На катоде быстрее восстанавливаются ионы, молекулы, атомы, имеющие наибольшее значение электродного потенциала.
Практическая последовательность восстановления на катоде при электролизе водных растворов:
1) ионы металлов от конца ряда напряжений до цинка: Аи3+.........Zn2+ по уравнению: 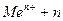 ē
ē 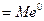 Металл при этом выделяется в свободном виде.
Металл при этом выделяется в свободном виде.
2) молекулы воды: 2Н2О + 2ē = Н2↑ + 2ОН-
Если в растворе одновременно находятся катионы нескольких металлов, то при разных концентрациях их в первую очередь на катоде разряжаются ионы того металла, у которого больше величина электродного потенциала.
Например, если в растворе одновременно присутствуют в равных концентрациях различные катионы (Zn2+, Au3+, Cu2+, Fe2+), то, в соответствии с величинами их электродных потенциалов, катионы будут восстанавливаться в следующей последовательности: Au3+, Cu2+, Fe2+, Zn2+.
На аноде легче всего окисляются ионы, молекулы, атомы, имеющие наименьшее значение электродного потенциала.
Практическая последовательность окисления на аноде при электролизе водных растворов:
а) анод - инертный:
1) анионы бескислородных кислот: Se2-, S2-, I-, Вг-, Сl- (кроме F-) до соответствующих соединений в свободном виде Se, S, I2, Br2, Cl2↑;
2) молекулы воды; 2Н2О - 4ē = О2↑ + 4Н+
б) анод — активный:
окисляется сам анод: Мео -nē =Мen+
Схема электролиза некоторых солей.
1. Электролиз расплава хлорида магния с инертным анодом.
Расплав содержит ионы магния Mg2+ и хлорид-ионы CI-, при пропускании тока ионы магния перемещаются к катоду, а хлорид-ионы - к аноду. Принимая от катода по два электрона, ионы магния превращаются в нейтральные атомы, выделяющиеся из расплава. Катод постепенно покрывается магнием.
Хлорид-ионы, достигая анода, отдают ему электроны и превращаются в атомы хлора. У анода выделяется хлор.
Схематически процесс электролиза расплава хлорида магния можно изобразить: MgCI2 = Mg2+ + 2Cl-
(-) Катод: Mg2+ + 2ē = Mg°
(+) Анод:2Сl--2ē = С12↑
Суммарная реакция: MgCI2 = Mg + CI2↑
2. Электролиз раствора нитрата калия с инертным анодом.
Раствор содержит ионы калия К+, нитрат-ионы NO3-, молекулы воды. В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
K+ (+) Катод: 2Н2О + 2ē = H2↑+ 2ОН-
NO3- (-) Анод: 2Н2О - 4ē = О2↑ + 4Н+
В прикатодном пространстве будет образовываться щелочь KOH, а в прианодном – кислота HNO3.
Суммарная реакция в молекулярно-ионном виде:
6Н2О = 2Н2↑ + О2↑+ 4ОН - + 4Н+
В молекулярном виде:
4KNO3 + 6Н2О = 2Н2↑ + О2↑ + 4КOН + 4HNO3
3. Электролиз раствора сульфата никеля с никелевым анодом.
В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
(-) Анод: Ni0 - 2ē = Ni2+
(+) Катод: Ni2+ + 2ē = Ni0
Весь процесс сводится к выделению никеля на катоде и постепенному растворению никелевого анода. Количество сульфата никеля в растворе остается неизменным.
Практическая часть
Электролиз водных растворов проводится в приборе, представленном на рисунке 10.1. В качестве инертных электродов используются графитовые стержни карандашей.

Рис. 9.1. Прибор для проведения электролиза
1 -U - образный сосуд с раствором электролита,
2 - электроды,
3 - токопроводящие проволоки.
4 - ИСТОЧНИК постоянного ТОКа
Опыт №1. Электролиз с нерастворимыми электродами.
Электролизер (U - образную трубку) наполните, не доходя до краев ~ 1см, раствором соли, указанном в задании. Опустите в оба колена трубки электроды, включите прибор, отметьте все видимые изменения. Напишите уравнения катодного и анодного процессов, суммарное уравнение в ионно-молекулярном и молекулярном виде.
Идентификация продуктов, образующихся при электролизе солей
на аноде:
1. Хлор – газ - определяется по резкому запаху, при появлении первых признаков которого прибор следует выключить.
2. Йод определяется по появлению коричневой окраски, характерному запаху, с помощью йодкрахмальной индикаторной бумаги.
З. Кислород - газ без запаха.
на катоде:
1. Водород - газ без запаха.
2. Если на катоде не выделяется водород, то осаждается металл в виде красноватого налета (медь), блестящих игольчатых кристаллов (цинк, свинец) и т.д.
Опыт №2. Электролиз с активным анодом.
Опыт выполняется аналогично опыту №1. Один графитовый электрод заменяетсяметаллическим (железо, алюминий, цинк, медь), который подключается к положительному полюсу внешнего источника. Раствор соли для электролиза взять из опыта №1 по указанию преподавателя.
Указания по технике безопасности
1. Настоящая работа имеет повышенную опасность, так как в ней применяется электрический ток.
2. Присоединять прибор к источнику тока только после того, когда электроды вставлены в раствор.
3. Не прикасайтесь к открытым токоведущим частям.
Лабораторная работа № 10
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1262; Нарушение авторских прав?; Мы поможем в написании вашей работы!