
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Описание прибора
|
|
|
|
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию за счет различия величин электродных потенциалов двух электродных реакций.
Наиболее простой цинково-медный гальванический элемент был создан Даниэлем и Якоби. Схема его представлена на рисунке.
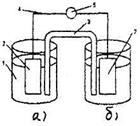
Рис.8.1. Схема гальванического элемента Даниэля - Якоби
1 -стаканы с растворами: а) сульфата пинка; б) сульфата меди
2 - цинковый и медный электроды
3 - электролитический ключ
4 - токопроводящая проволока
5 – гальванометр
Элемент устроен и работает следующим образом: в два сосуда с растворами (один – ZnSO4, а другой- CuSO4) опущены цинковая и медная проволоки (электроды) соответственно, которые соединены медной проволокой.
Величины стандартных электродных потенциалов цинка и меди соответственно равны Zn/Zn 2+ = - 0,76 В, Cu/Cu 2+ = +0,34 В и указывают, что на поверхности цинка, как более активного металла, больше электронов, чем на меди. При погружении в сосуды электролитического ключа (U - образной трубки, соединяющей сосуды между собой), наполненного электролитом, электроны с цинкового электрода будут перемешаться к медной пластине, при этом замкнется внешняя электрическая цепь.
Цинковый электрод начнет окисляться, посылая ионы Zn2+ в раствор:
Zn-2ē= Zn2+
Прибывшие на медный электрод электроны будут восстанавливать ионы меди, находящиеся в растворе: Сu2+ + 2ē = Сu°, атомы меди осаждаются на электроде. Медный электрод является катодом, цинковый - анодом.
Ионы 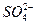 , оставшиеся после восстановления ионов меди, будут перемещаться по электролитическому ключу в сосуд с сульфатом цинка в эквивалентном количестве с образующимися ионами цинка и замкнут электрическую цепь.
, оставшиеся после восстановления ионов меди, будут перемещаться по электролитическому ключу в сосуд с сульфатом цинка в эквивалентном количестве с образующимися ионами цинка и замкнут электрическую цепь.
Суммарный процесс, протекающий на электродах, можно изобразить общим уравнением:
Zn0 + Cu2+ = Zn2+ + Cu0
Гальванический элемент будет работать до тех пор, пока не сравняются потенциалы медного и цинкового электродов. Работа элемента Даниэля - Якоби опишется схемой:
(-) Zn/ZnSO4//CuSO/Cu(+)
Для определения электродвижущей силы (ЭДС) гальванического элемента надо из потенциала катода вычесть потенциал анода. Величина ЭДС медно-цинкового гальванического элемента для стандартных условий составит:
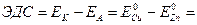 0,34 - (-0,76) = 1,1 (В)
0,34 - (-0,76) = 1,1 (В)
Практическая часть.
Опыт №1. Активность металлов в растворах электролитов.
В три пробирки внесите растворы указанных солей. Опустите во все пробирки, хорошо зачищенные данные металлы. Составьте электронные уравнения протекающих реакций. Сделайте вывод о течении их с точки зрения электродных потенциалов металлов или о невозможности протекания других реакций.
Задания:
Соли Металл
1. Pb(NO3)2, CuCl2, ZnSO4 железо
2. CuSO4, BaCl2, FeSO4 цинк
3. Pb(NO3)2, CuCl2, MgCl2 алюминий
4. Hg(NO3)2, NaCl, CuSO4 олово
5. Hg(NO3)2, FeSO4, ZnSO4 медь
6. CuSO4, K2CrO4, Na2CO3 магний
7. Hg(NO3)2, NaCl, CuSO4 свинец
8. CuSO4, K2CrO4, Na2CO3 цинк
Опыт №2. Работа гальванического элемента Даниэля-Якоби.
Приготовьте раствор сульфата цинка нужной концентрации путем разбавления имеющегося раствора ZnSO4 концентрации 2н водой в мерном цилиндре (например, для приготовления раствора 0,1н надо разбавить в 2:0,1= 20 раз. Это можно сделать в два этапа: 1) разбавить в два раза, налив воды и раствора сульфата цинка поровну;
2) полученный раствор разбавить в 10 раз, для этого налить в мерный цилиндр 1 мл раствора и долить воды до 10 мл.
Соберите гальванический элемент по схеме, изображенной на рисунке 8.1. Дня этого налейте в один стакан, чуть-чуть не доходя до края, раствор сульфата цинка указанной концентрации, а в другой - столько же раствора сульфата меди указанной концентрации.
Заполните электролитический ключ - изогнутую стеклянную трубочку - раствором сульфата калия так, чтобы в трубочке не было воздушных пузырей, которые разомкнут электрическую цепь. Соедините оба стакана заполненным электролитическим ключом следующим образом: плотно закрыв пальцем один конец трубочки, другой опустите в стакан с раствором соли, быстро опустите второй конец в другой стакан. Если электролит выльется из трубочки в процессе погружения, то эту операцию необходимо повторить.
В раствор сульфата цинка опустите хорошо зачищенный цинковый электрод, в сульфат меди - медный электрод. Наблюдайте отклонение стрелки вольтметра. Напишите уравнения анодного и катодного процессов. Рассчитайте электродные потенциалы с учетом указанных концентраций по уравнению Нернста, ЭДС гальванического элемента. Сравните его значение с показанием вольтметра.
Задания:
1. Zn/ZnSO4 (0,2 н)//CuSO4(2h)/Cu
2. Zn/ZnSO4, (0,125 h)//CuSO4 (2h)/Cu
3. Zn/ZnSO4 (0,4 h)//CuSO4(2h)/Cu
4. Zn/ZnSO4 (0,5н)/CuSO4(2н)/Cu
5. Zn/ZnSO4 (0,025н)//CuSO4(2н)/Cu
6. Zn/ZnSO4(0,04н)//CuSO4(2н)/Cu
7. Zn/ZnSO4 (0,02н)//CuSO4(2н)/Cu
8. Zn/ZnSO4 (0,2н)//CuSO4(1н)/Cu
Опыт №3. Работа концентрационного гальванического элемента.
В качестве электродов используется один и тот же металл, опушенный в раствор соответствующей соли.
Задания:
1. Fe/FeSO4(2M)//FeSO4(0,1н)/Fe
2. Al/Al2(SO4)3(0,3M)//Al2(SO4)3(0,03н)/Аl
3. Co/CoSO4(4н)/Со//СоSO4(0,02M)
4. Ag/AgNO3(2н)//AgNO3(0,5M)/Ag
5. Cd/CdSO4(0,8M)//CdSO4(0,04н)/Cd
6. Mn/MnSO4(0,5н)//MnSO4(0,5M)/Mn
7. Bi/Bi(NO3)3(3н)//Bi(NO3)3(0,006M)/Bi
8. Mg/MgSO4(0,01M)//MgSO4(0,0002н)/Mg
Формулы для расчетов:
1. Пересчитайте нормальную концентрацию Сн в молярную концентрацию СМ:
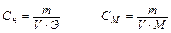 , отсюда
, отсюда 
Эквивалентная масса ионов металла равна
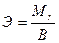
 ,
,
где  – молярная масса ионов металла,
– молярная масса ионов металла,
В – валентность металла.
Подставив Э в формулу для СМ, получим: 
2. Вычислите электродный потенциал по уравнению Нернста.
3. Вычислите ЭДС как разность потенциалов катода и анода.
Лабораторная paбoтa №9
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 399; Нарушение авторских прав?; Мы поможем в написании вашей работы!