
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Кроме оснований и кислот, растворы которых имеют кислую или щелочную среду, растворы солей имеют также кислую или щелочную среду, реже - нейтральную.
Причиной изменения рН раствора являются обменные реакции взаимодействия ионов солей с молекулами воды, называемые реакциями гидролиза.
Процесс гидролиза является обратимым. В растворе соли, подвергшейся гидролизу, устанавливается равновесие между солью и продуктами гидролиза:
KtAn + H2O 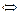 KtOH + HAn,
KtOH + HAn,
количественно характеризующееся константой гидролиза:
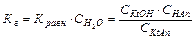
Тип реакции гидролиза и, соответственно, характер среды водных растворов солей зависит от химической природы катионов и анионов, образующих соли. Гидролизу подвергается не вся соль в растворе. Отношение числа гидролизованных молекул соли к общему числу растворенных молекул называется степенью гидролизаh. Чем слабее кислота (или основание), тем больше степень гидролиза ее соли. Константа и степень гидролиза связаны между собой соотношением:
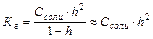
Из данного выражения следует, что при уменьшении концентрации соли (при разбавлении раствора) степень гидролиза соли увеличивается, т.е. равновесие реакции гидролиза смещается в сторону образования продуктов гидролиза.
Реакция гидролиза протекает с поглощением теплоты (эндотермическая реакция). Поэтому при повышении температуры, по принципу Ле Шателье,равновесие реакции гидролиза смещается в сторону продуктов гидролиза, т.е. степень гидролиза соли увеличивается.
Итак, для уменьшения степени гидролиза растворы солей следует хранить концентрированными и при низких температурах.
Гидролиз имеет большое значение. Разрушение горных пород обусловлено в значительной мере гидролизом составляющих их минералов - алюмосиликатов. Твердение вяжущих веществ, осахаривание крахмала, гидролиз древесины, получение мыла и много других важных производств основано на гидролизе.
Различают три случая обратимого гидролиза солей: катионный, анионный и катионно-анионный. Такая классификация реакций гидролиза дается по тому иону соли, который связывает ионы Н+ или ОН- в слабый электролит: кислоту, гидроокись, кислый анион, основной катион.
Катионный гидролиз
Этому виду гидролиза подвергаются соли, образованные слабым основанием и сильной кислотой, например: CuSO4, FeCl3, NH4CI, Zn(NO3)2, MnBr2 и др. Гидролиз такого типа солей обусловлен связыванием катионов слабых гидроксидов Cu2+, Fe3+, NH4+, Zn2+, Mn2+с гидроксид-ионами воды и образованием слабого основания в случае катиона одновалентного металла и основной соли в случае катиона многовалентного металла.
Например, гидролиз соли MnBr2, образованной слабым основанием и сильной кислотой, происходит в 2 стадии. При комнатной температуре гидролиз идет преимущественно по 1-й ступени. Сокращенное ионно-молекулярное уравнение 1-й ступени, отражающее суть реакции, выглядит следующим образом:
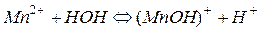
Из уравнения следует, что при гидролизе солей по катионному типу в растворе накапливаются ионы Н+, поэтому среда становится кислой (рН<7).
Значение константы гидролиза можно рассчитать либо на основании равновесных концентраций участников реакции гидролиза:
 ,
,
либо используя табличные значения константы соответствующего этапа диссоциации слабого основания:
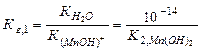
Полное ионно-молекулярное уравнение катионного гидролиза получается добавлением в обе части сокращенного ионно-молекулярного уравнения анионов сильной кислоты:
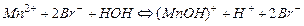
Молекулярное уравнение получают, объединяя ионы в молекулы:

Таким образом, на первом этапе гидролиза образуется основная соль MnOHBr.
При нагревании и разбавлении раствора гидролиз усиливается и протекает вторая ступень гидролиза. Сокращенное ионно-молекулярное уравнение 2-й ступени имеет вид:
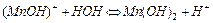 ,
, 
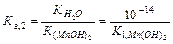
полное ионно-молекулярное уравнение:  ,
,
и молекулярная форма 2-й ступени: 
Анионный гидролиз
Анионному гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой, например: Li2CO3, К3РО4, Ва(СН3СОО)2, CaS, Na2B4O7. Гидролиз этого типа солей обусловлен связыванием анионов слабых кислот - 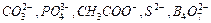 - с катионом Н+ воды с образованием слабой кислоты а случае, если анион соли одновалентен и кислой соли, если анион соли многовалентен.
- с катионом Н+ воды с образованием слабой кислоты а случае, если анион соли одновалентен и кислой соли, если анион соли многовалентен.
Например, гидролиз соли Li2CO3, образованной сильным основанием и слабой кислотой, происходит в 2 стадии. При комнатной температуре гидролиз идет преимущественно по 1-й ступени. Сокращенное ионно-молекулярное уравнение 1-й ступени, отражающее суть реакции, выглядит следующим образом:
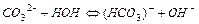
Из уравнения следует, что при гидролизе солей по анионному типу в растворе накапливаются ионы ОН-, поэтому среда становится щелочной (рН>7).
Значение константы гидролиза можно рассчитать либо на основании равновесных концентраций участников реакции гидролиза:
 ,
,
либо используя табличные значения константы соответствующего этапа диссоциации слабой кислоты:
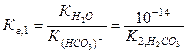
Полное ионно-молекулярное уравнение анионного гидролиза получается добавлением в обе части сокращенного ионно-молекулярного уравнения катионов сильного основания:
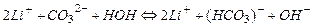
Молекулярное уравнение получают, объединяя ионы в молекулы:
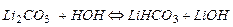
Таким образом, на первом этапе гидролиза образуется кислая соль LiHCO3.
При нагревании и разбавлении раствора гидролиз усиливается и протекает вторая ступень гидролиза. Сокращенное ионно-молекулярное уравнение 2-й ступени имеет вид:
 ,
, 

полное ионно-молекулярное уравнение:  ,
,
и молекулярная форма 2-й ступени: 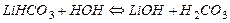
Катионно-анионный гидролиз
Катионно-анионному гидролизу подвергаются соли, образованные слабым основанием и слабой кислотой, например: Fе(CH3COO)2, (NH4)2SO4, NH4CN, CH3COONH4.
Гидролиз данного типа протекает в результате связывания катионов соли с ионами ОН- и анионов соли с ионами Н+ воды с образованием слабых электролитов, например, для соли CH3COONH4:
СН3СОО- + NН4+ + Н2О 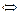 СН3СООН + NH4ОН,
СН3СООН + NH4ОН,
или в молекулярной форме:
СН3СООNН4 + Н2O 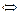 СH3СООН + NH4OH;
СH3СООН + NH4OH;
рН среды в таких растворах зависит от относительной силы образующихся слабой кислоты и слабого основания. В данной реакции рН = 7, так как константы диссоциации CH3COOH и NH4OH равны. Если соли образованы очень слабыми гидроксидами и очень слабыми кислотами, то они гидролизуются необратимо и продукты гидролиза их выходят из сферы реакции в виде осадка, газа или слабодиссоциирующего вещества, например:
Сг2S3 + 6Н2О = 2Сг(ОН)3↓ +3H2S
Соли, не подвергающиеся гидролизу
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, так как ни один из ионов такой соли не связывается с ионами воды в слабый электролит. Примеры таких солей: KNO3, Na2SO4, CaCl2, NaI и т.д.
Водные растворы таких солей имеют нейтральную среду, рН = 7.
Практическая часть
Пояснения к проведению опытов 1,2,3
Опыты №1,2,3 выполняются следующим образом: на полоску универсальной индикаторной бумаги нанести несколько капель раствора, а затем сравнить окраску бумаги со шкалой. Оформить опыты, выбрав подходящее название для 2 и 3 опыта.
Опыт №1. Индикаторный метод определения рН растворов.
Измерить значения рН растворов кислот и оснований, а также 2-х солей, указанных преподавателем, результаты занести в табл.6.1.. На основании измеренных значений рН рассчитать для каждого из растворов концентрации ионов Н+ и ОН-, а также указать реакцию среды (кислая, нейтральная или щелочная). Расчетные формулы и пример расчета для одного из растворов привести после таблицы.
Таблица 6.1. Значения рН водных растворов электролитов
| Название растворов | рН растворов |  ,
моль/л ,
моль/л
| 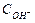 ,
моль/л ,
моль/л
| Реакция среды |
| 1. Дист. вода 2. СН3СООН 3. HCl 4. NH4OH 5. NaOH 6. 7. |
Опыт №2. Гидролиз соли, образованной сильным основанием ц слабой кислотой.
По характеру среды водного раствора выбрать соль, относящуюся к данному типу. Написать уравнение гидролиза соли в молекулярной и ионно-молекулярных формах.
На основании измеренного значения рН данной соли и табличного значения константы диссоциации слабой кислоты рассчитать константу и степень гидролиза данной соли.
Опыт №3. Гидролиз соли, образованной слабым основанием и сильной кислотой.
По характеру среды водного раствора выбрать соль, относящуюся к данному типу. Написать уравнение гидролиза соли в молекулярной и ионно-молекулярных формах.
На основании измеренного значения рН данной соли и табличного значения константы диссоциации слабого основания рассчитать константу и степень гидролиза данной соли.
Опыт №4. Влияние разбавления на степень гидролиза
Разбавить исходный 0,1М раствор одной из солей водой в 10 раз с помощью мерного цилиндра, измерить рН полученного раствора и сравнить его с измеренным ранее рН соли до разбавления. Сделать вывод о
влиянии разбавления на степень гидролиза.
Опыт №5. Влияние нагревания на степень гидролиза
Раствор одной из солей налить в микропробирку и нагреть до 50 – 600С путем помещения на водяную баню. Измерить рН нагретого раствора соли и сравнить его с измеренным ранее рН соли при комнатной температуре. Сделать вывод о влиянии температуры на степень гидролиза.
Лабораторная работа №7
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1544; Нарушение авторских прав?; Мы поможем в написании вашей работы!