
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация. Реакции ионного обмена
|
|
|
|
Формулы для расчета.
1. Вычислить нормальную концентрацию раствора кислоты (оп.№1) или раствора щелочи (оп.№2) из формулы закона эквивалентов для растворов:

2. Вычислить массу кислоты (оп.№1) или щелочи (оп.№2), содержащейся в 10 мл соответствующего раствора, из формулы нормальной концентрации:

3. Вычислить массу воды (растворителя) в 10 мл раствора, считая плотность раствора равной 1:


4. Пользуясь полученными данными, вычислить заданные концентрации по соответствующим формулам.
Лабораторная работа №5
Цель работы: изучить условия протекания реакций ионного обмена и правил написания ионообменных реакций в молекулярной и ионно-молекулярной формах.
Теоретическая часть.
Электролитической диссоциацией называется частичный или полный распад молекул электролита на ионы под действием полярных молекул растворителей. Диссоциация протекает в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителей. Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов - гидратацией) ионов. В растворах электролитов образуются сольватированные ионы.
Электролиты проводят электрический ток, так как в растворах имеются заряженные частицы: катионы и анионы.
Количественно процесс диссоциации характеризуется степенью электролитической диссоциации α. Степенью диссоциации называется отношение числа молекул, распавшихся на ионы n к общему числу молекул N растворенного вещества:
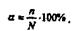
Степень диссоциации выражается в процентах или долях единицы.
Электролиты делятся на три группы: а) сильные (α>30%), б) средние (3<α<30%), в) слабые (α<3%).
В учебной литературе приведены таблицы степеней диссоциации кислот, основании и солей. Степень диссоциации зависит от природы растворенного вещества и растворители, температуры, концентрации и присутствия в растворе одноименных ионов. Для слабых электролитов степень диссоциации существенно зависит от концентрации: чем меньше концентрация раствора, тем больше степень электролитической диссоциации.
Значительно удобней характеризовать способность электролитов к диссоциации к растворе константой диссоциации К, которая не зависит от концентрации раствора. Константа диссоциации К представляет собой константу равновесия обратимого процесса диссоциации слабого электролита – кислоты или основания. Константа диссоциации кислот называют также константой кислотности, а оснований – константой основности. Значения констант диссоциации слабых электролитов приведены в таблицах для стандартных условий.
Пример:
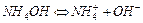
Константа диссоциации (основности) выражается отношением произведения равновесных концентраций ионов в растворе данного слабого электролита к концентрации недиссоциированных молекул:
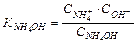
Константа диссоциации является мерой относительной силы слабых электролитов: чем она меньше, тем слабее электролит. Связь между константой и степенью диссоциации слабого бинарного электролита подчиняется закону разведения Оствальда:

Кислотами с точки зрения электролитической диссоциации называются электролиты, образующие в водных растворах положительно заряженные ноны водорода и анионы кислотного остатка. Ионы водорода являются характерными для кислот и определяют их свойства. Кислоты, являющиеся сильными электролитами: азотная HNО3, соляная НСl, бромоводородная НВг, иодоводородная HJ, серная H2SO4, марганцовая НМnО4 и другие.
Слабых электролитов значительно больше, чем сильных. Слабыми электролитами являются кислоты: сернистая H2SO3, фтороводородная HF, угольная H2СO3, сероводородная H2S, уксусная CH3COOН и др. Многоосновные кислоты диссоциируют ступенчато. Примеры диссоциации кислот:
HCl = H+ + Cl ‑
CH3COOH 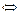 CH3COO‑ + H+
CH3COO‑ + H+
I ступень: H2SO3 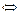 H++ HSО3‑
H++ HSО3‑
или H2SO3 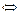 2H++ SО32-,
2H++ SО32-,
II ступень: HSО3‑ 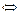 H+ + SО32 ‑
H+ + SО32 ‑
С точки зрения электролитической диссоциации основаниями называются электролиты, образующие в водных растворах отрицательно заряженные гидроксид-ионы ОН ‑ и катионы металлов. Гидроксид-ионы обуславливают общие свойства оснований. Основания с валентностью катиона больше единицы диссоциируют ступенчато. Сильными электролитами являются основания, в которых катионами являются щелочные и щелочноземельные металлы, за исключением Вe(ОН)2 и Mg(OH)2.
В основном основания являются слабыми электролитами, особенно образованные амфотерными металлами. Амфотерные гидроксиды вкислой среде диссоциируют как основания, в щелочной - как кислоты. Примеры диссоциации оснований и амфотерных гидроксидов:
NaOH = Na+ + OH-
1ст. Fe(OH)2 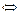 FeOH++OH-
FeOH++OH-
II ст. FeOH+ 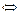 Fe2+ + OH- или Fe(OH)2
Fe2+ + OH- или Fe(OH)2 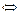 Fe2+ + 2OH-
Fe2+ + 2OH-
Zn2+ + 2OH- 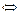 Zn(OH)2
Zn(OH)2 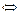 H2ZnО2
H2ZnО2 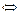 2H+ + ZnO22-
2H+ + ZnO22-
Солями называются электролиты, диссоциирующие а воде на положительные ионы металла и отрицательные ионы кислотного остатка, Все соли, хорошо растворимые в воде,, являются сильными электролитами. Примеры диссоциации нормальных (средних), кислых, основных, комплексных и двойных солей:
КВг = К+ + Вг-; K3[Fe(CN)6]=3K++[Fe(CN)6]3-;
NaHCO3 = Na+ + HCO3-; KAl(SO4)2 = K+ + Al3+ + 2SO42-.
АlOHCl2 =АlOН2++2С1-;
Изучение различных реакций, в основном в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, согласно которой кислотой является донор протона, то есть частица (молекула или ион), которая способна отдавать ион водорода - протон, а основанием - акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Например, в реакции:
HC1+NH3 = NH4+ + Cl-
ион С1- - основание, сопряженное кислоте НCl, а ион NH4+- кислота, сопряженная основанию NH3. Реакции в растворах электролитов протекают между ионами, на которые распадаются молекулы растворенных веществ. Реакции записывают в трех формах: молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной. Сильные электролиты записываются в виде ионов, средние и слабые электролиты, осадки и газы - в виде молекул. Сущность реакции отражается сокращенным ионно-молекулярным уравнением, в котором указываются только частицы, которые непосредственно вступают в реакцию и не указываются ионы и молекулы, концентрация которых существенно не изменяется. Реакции между электролитами протекают в сторону образования газа, осадка или более слабого
электролита.
Пример реакции в растворах электролитов: нейтрализация слабым основанием (гидроксидом аммония) сильной азотной кислоты. Молекулярное уравнение реакции:
HNO3 + NH4OH = NH4NO3 + Н2О.
В этой реакции сильные электролиты - азотная кислота и образующаяся соль- нитрат аммония, которые записываем в виде ионов, а слабые - гидроксид аммония и вода, которые записываем в виде молекул. Полное ионно-молекулярное уравнение имеет вид:
Н+ + NО3- + NH4OH = NH4+ + NO3- + Н2О.
Как видно, не претерпевают изменений в ходе реакции только ионы NО3-, исключая их, записываем сокращенное ионно-молекулярное уравнение:
H+ + NH4OH = NH4+ + H2O.
Практическая часть
Ионно - молекулярные реакции обмена
Провести реакции между растворами электролитов согласно заданию. Для этого в пробирку налить 7-8 капель одного реактива и добавить 7-8 капель другого реактива. Отметить признаки реакции: выпадение осадка, выделение газа или изменение запаха (что свидетельствует об образовании малодиссоциирующего вещества).
Затем, в соответствии с наблюдаемыми признаками, отнести реакцию к одному из 3-х типов:
1) ионообменные реакции с образованием малорастворимого вещества (осадка);
2) ионообменные реакции с выделением газа;
3) ионообменные реакции с образованием слабого электролита.
Каждую реакцию записать в 3-х формах:
а) молекулярной,
б) полной ионно - молекулярной,
в) сокращенной ионно - молекулярной.
Сделайте вывод о направлении протекания реакций ионного обмена.
Список заданий:
| 1. CH3COONa+H2SO4 2. NaNO2+ H2SO4 3. MgCl2+Na3PO4 4. NH4Cl+KOH 5. Na2CO3+HCl 6. Na2CO3+Ba(NO3)2 7. (CH3COO)2Pb+HCl 8. Hg(NO3)2+NaOH 9. H2SO4+BaCl2 10. NaCl+Pb(NO3)2 11. NiSO4+KOH 12. NaNO2+HCl 13. Bi(NO3)3+KOH 14. Na2S+CdCl2 15. Bi(NO3)3+Na2S 16. CoSO4+KOH 17. CuSO4+KOH 18. Na2CO3+HNO3 19. K2CrO4+ CuSO4 20. K2CrO4+ MnSO4 21. K2CrO4+ NiSO4 22. K2CO3+ MnSO4 23. Na2SO3+HCl | 24. Hg(NO3)2+Na2S 25. NiSO4+ NH4OH 26. NiSO4+ NH4OHизб 27.AlCl3+KOH 28. FeCl3+Na3PO4 29. K2CrO4+ Ba(NO3)2 30. NaNO2+HNO3 31. MgCl2+ NaOH 32. CuSO4+ NH4OH 33. CuSO4+ NH4OHизб 34. AlCl3+KOHизб 35. Pb(NO3)2+KI 36. CH3COOK+ HCl 37. Al2(SO4)3+NaOH 38. Al2(SO4)3+NaOHизб 39. CoSO4+ Na2S 40. Pb(NO3)2+ Na3PO4 41. Na3PO4+ CuSO4 42. CH3COOK+ HNO3 43. CH3COOH+KOH 44. CoSO4+ NH4OH 45. CoSO4+ NH4OHизб 46. Hg(NO3)2+ KI | 47. Hg(NO3)2+ KIизб 48. CdCl2+ NH4OH 49. CdCl2+ NH4OHизб 50. NaHCO3+ HNO3 51. ZnSO4+ BaCl2 52. ZnSO4+KOH 53. ZnSO4+KOHизб 54. (CH3COO)2Pb+ H2SO4 55. NaHCO3+H2SO4 56. (NH4)2SO4+KOH 57. K2CO3+ H2SO4 58. (NH4)2SO4+NaOH 59. K2CO3+ HCl 60. CrCl3+KOH 61. CrCl3+KOHизб 62. ZnCl2+NaOH 63. ZnCl2+NaOHизб 64. MnSO4+KOH 65. MnSO4+Na3PO4 66. Na2SO3+ H2SO4 67. K2CO3+ CH3COOH 68. Na2CO3+CH3COOH 69. NaHCO3+CH3COOH |
Лабораторная работа №6
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1703; Нарушение авторских прав?; Мы поможем в написании вашей работы!