
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение тепловых эффектов химических реакций
|
|
|
|
Цель работы: определить опытным путем тепловые эффекты процессов растворения из полученных данных, пользуясь законом Гесса, рассчитать теплоты гидратации солей.
Теоретическая часть.
Все химические реакции сопровождаются выделением или поглощением энергии, чаще всего в виде тепла Количество последней может быть измерено и выражено в единицах энергии (Дж, кал и т.д.)
Разница первоначального и конечного уровней энергии системы представляет собой энергетический эффект или изменение энтальпии реакции, который обозначается ΔНr.
При экзотермических реакциях система с большим запасом энергии переходит в состояние с меньшим запасом энергии. Такие реакции сопровождаются выделением тепла, и их тепловой эффект считается отрицательным (ΔНr <0).
При эндотермических реакциях, наоборот, система с меньшим запасом энергии переходит в состояние с более высоким запасом энергии. Такие реакции сопровождаются поглощением тепла, и их тепловой эффект принято считать положительным (ΔНr >0).
Для термохимических расчетов большое значение имеют величины энтальпий образования веществ.
Под энтальпией образования вещества понимается изменение энтальпии реакции образования одного моля сложного вещества из простых веществ, например:
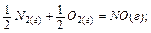
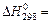 +90,4 кДж/моль;
+90,4 кДж/моль;
Верхний и нижний индексы при ΔН указывают на то, что энтальпия образования приведена к стандартным условиям (давление 101325 Па или 1 атм и температура 298 К или 250 С).
Значения энтальпий образования веществ приведены в таблицах термодинамических потенциалов.
Термохимические расчеты основаны на использовании закона Гесса и вытекающих из него следствий:
1. Тепловой эффект химического процесса равен сумме тепловых эффектов всех промежуточных стадий процесса.
Например, процесс получения двуокиси углерода из угля и кислорода может быть проведен в одну стадию:
С(т) + О2(г) = СО2(г) ΔНr = -94 ккал
Но этот же процесс можно провести в две стадии:
С(т) + 1/2 О2(г) -= СО(г) ΔНr = -26,4 ккал
CO(г) + 1/2O2(г) = CO2(г) ΔНr =-67,6 ккал
Согласно закону Гесса, сумма тепловых эффектов двух последних реакций должна равняться тепловому эффекту первой реакции, что и наблюдается в действительности: {-26,4-67,6 = -94 (ккал)}.
2. Тепловой эффект химической реакции равен разности теплот образования конечных и исходных участников реакции, умноженных на их стехиометрические коэффициенты (т.e. коэффициенты перед формулами данных веществ в уравнении реакции).
Например, реакция горения пропана протекает по схеме:
С3Н8(г) + 5Ог(г) = ЗСО2(г) + 4Н2О(г)
Теплоты образования 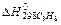
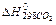 и
и 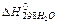 соответственно равны -103,8; -393,6 и-241,9 кДж/моль.
соответственно равны -103,8; -393,6 и-241,9 кДж/моль.
Тепловой эффект реакции горения С3Н8(г) рассчитывается по формуле:
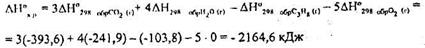
Практическая часть
Методика проведения опытов:
Для определения тепловых эффектов процессов, протекающих в водных растворах, используют простейший калориметр, приведенный на рис 2.1.
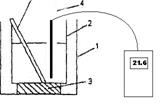
Рис.2.1. Схема калориметра:
1 - внешний стакан калориметра; 2 -внутренний стакан калориметра, 3 - теплоизолирующая прокладка; 4-термометр; 5 - мешалка.
Так как слой воздуха, находящийся между стенками внешнего и внутреннего стаканов калориметра, является хорошим теплоизолятором, то все тепло, выделяющееся (или поглощающееся) в результате протекания реакции, идет на нагревание (или охлаждение) реакционной смеси и внутреннего стакана калориметра. Экспериментально определяется изменение температуры реакционной смеси, сопровождающее данный процесс. Для этого во внутренний стакан калориметра отмеривают с помощью мерного цилиндра 25 - 30 мл воды и измеряют начальную температуру tнач. с помощью термометра, который помещают непосредственно в жидкость, следя, чтобы он не касался дна и стенок внутреннего стакана (см. рис.1).
Не вынимая термометра из жидкости, во внутренний стакан засыпают сухую соль. Раствор перемешивают мешалкой до полного растворения, следя одновременно за показаниями термометра. Температура в ходе процесса может повышаться или понижаться. Конечную температуру tкон. фиксируют в тот момент, когда столбик термометра останавливается.
Все данные, необходимые для расчетов, сводят в таблицу (форма таблицы дана в описании опытов).
Тепловой эффект процесса, протекающего в калориметре, рассчитывается по формуле:
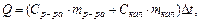
где Ср.ра - удельная теплоемкость раствора, находящегося во внутреннем стакане калориметра, которую можно принять равной удельной теплоемкости воды Сн 0 - 4,18 Дж/г град;
тр-ра — масса раствора во внутреннем стакане калориметра, г;
Скал - удельная теплоемкость внутреннего стакана калориметра;
ткал — масса калориметра;
Δt - изменение температуры в ходе опыта, град С.
Учитывая, что удельная теплоёмкость стекла, из которого сделан внутренний стакан калориметра, мала, вторым слагаемым можно пренебречь, тогда формула для расчета теплового эффекта примет вид:
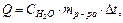
Опыт №1. Определение мольной теплоты растворения соли.
Опыт проводят согласно описанию с выданной преподавателем навеской соли. Химическая формула соли и ее масса указаны на обертке навески. Данные, необходимые для расчета, сводят в таблицу 2.1.
Таблица 2.1. Параметры для расчета мольной теплоты растворения соли.
| Химическаяформула соли | 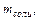 г
г
| 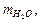 г
г
| 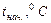
| 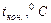
| 
| 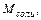 г/моль
г/моль
| 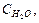 Дж/г·град
Дж/г·град
| 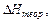 кДж/моль
кДж/моль
|
| 1. | 4,18 | |||||||
| 2. | 4,18 |
Мольную теплоту растворения, то есть теплоту, выделяющуюся или поглощающуюся при растворении в воде 1 моля соли, рассчитывают по формуле:
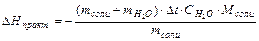
Пользуясь приведенной в конце работы таблицей, в которой приведены теоретические значения мольных теплот растворения некоторых солей, рассчитайте относительную погрешность определения:
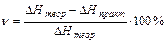
Опыт №2. Определены мольной теплоты гидратации соли.
Гидратацией называют процесс присоединения к соли определенного количества молекул воды с образованием кристаллогидрата данной соли, например:
Na2СO3 + l0H2O = Na2CO3 · 10Н2О.
Для определения мольной теплоты гидратации в воде растворяют сначала навеску
безводной соли:
Na2СO3 + п H2O = Na2CO3 · п Н2О; ΔНрастворения безв.соли
а затем навеску кристаллогидрата данной соли
Na2CO3 · 10Н2О + (п -10)H2O = Na2CO3 · п Н2О; ΔНрастворения кристаллогидрата
Оба процесса проводят согласно описанию, данному в практической части, и данные вносят в таблицу 2.1.
Пользуясь формулой для расчета мольной теплоты растворения, приведенной в 1-ом опыте, рассчитывают ΔН растворения безводной соли и кристаллогидрата.
Теплоту гидратации вычисляют, пользуясь законом Гесса:
ΔНрастворения безв.соли = ΔНгидратации + ΔНрастворения кристаллогидрата
Относительную погрешность определения рассчитывают исходя из данных табл.2.
Таблица 2.2. Мольные теплоты растворения и гидратации для некоторых солей и кристаллогидратов
| Формула соли или кристаллогидрата | ΔНгидратации, кДж/моль | ΔНрастворения, кДж/моль |
| CuSO4 · 5Н2О | 77,8 | +10,50 |
| ZnSO4 · 7H2O | -95,0 | +18,87 |
| K2Cr207 | +70,0 | |
| Na2CO3 безв. | -25.0 | |
| MgSO4 | -84,8 | |
| СаС12 | -72,8 | |
| Na2SO4·10H2O | 80,5 | |
| NH4NO3 | +26,8 | |
| Na2S2O3 | +27,6 |
Выводы:
в выводах каждого опыта должно быть указано, какой тип реакций - экзо- или эндотермическая - наблюдается для данной соли и на основании чего можно сделать такое заключение.
Лабораторная работа №3
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2491; Нарушение авторских прав?; Мы поможем в написании вашей работы!