
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металла по водороду
|
|
|
|
ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА И ЭКВИВАЛЕНТНОЙ МАССЫ
Подписано в печать. Формат 60х90 1/16.
Методические указания
Департамент кадров и учебных заведений
Самарский государственный университет путей сообщения
Кафедра "Общая и инженерная химия"
к выполнению лабораторных работ по химии для студентов всех специальностей
очной формы обучения
Составители: Л. М.Васильченко
Г. Б.Сеницкая
А. В.Халикова
В. М.Яковлев
Н.В.Сотова
Самара
УДК 546
Химия. Лабораторные работы по химии для студентов дневной формы обучения
всех специальностей. Самара: СамГУПС, 2009. - с.
Утверждено на заседании кафедры ОИХ, протокол № 9 от 09.04.2009г.
Печатается по решению редакционно-издательского совета университета
Составители: Васильченко Лидия Михайловна
Сеницкая Галина Борисовна
Халикова Алла Викторовна
Яковлев Виктор Михайлович
Сотова Наталья Васильевна
Редактор:
Комп. верстка:
Бумага писчая. Печать оперативная. Усл. п.л.
Тираж экз. Заказ №.
ã Самарский государственный университет путей сообщения, 2009
Введение
Настоящие указания, написанные коллективом кафедры общей и инженерной химии, представляют собой сборник лабораторных работ по общей химии, составленный в соответствии с Государственным образовательным стандартом высшего профессионального образования от 14 апреля 2000 года.
Методические указания содержат описания лабораторных работ.
Каждая работа включает теоретическую и практическую часть. Теоретическая часть содержит в сжатой форме основные сведения и расчетные формулы по теме лабораторной работы и предназначена для того, чтобы студенты сделали нужные выводы об изучаемых химических явлениях и процессах.
Практическая часть содержит описание опытов, проводимых полумикрометодом.
Студенты приступают к работе после предварительного обсуждения с преподавателем практического хода работы и содержания выводов, которые надлежит сделать после выполнения данной работы.
Рекомендуемая литература:
Основная:
1. Коровин Н.В. Общая химия. М.: Высшая школа, 2000.
2. Глинка Н.Л. Общая химия. М.: Высшая школа, 2001.
3. Курс химии. Ч.1, общетеоретическая / Под ред.Дмитриева Г.А., Лучинского Г.П. и Семишина В.И. М.: Высшая школа, 1991.
4. Глинка Н.Л. Задачи и упражнения по общей химии. М.: Высшая школа, 2001.
Учебно-методическая:
5. Справочный материал по дисциплинам «Химия» и «Коррозия металлов» для студентов 1 курса всех специальностей и форм обучения. Самара, СамГАПС, 2005г.
Лабораторная работа №1
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть.
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами.
Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль - это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02 .1023). Например: 3 .1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль. Эквивалентом элемента называется такое его количество, которое соединяется 1с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВг, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах, эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ, пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
 (1)
(1)
где: m, (V) - массы (объемы) реагирующих веществ;
Э, (Vэкв.) - эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
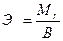
где 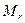 - мольная масса атома элемента,
- мольная масса атома элемента,
В - валентность элемента.
Так, например, эквивалентные массы водорода и кислорода соответственно равны:

Эквивалентный объем газа можно вычислить по формуле:
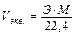
Так, например, эквивалентные объемы водорода и кислорода соответственно равны:

Эквивалентные массы сложных веществ можно вычислить по формулам:
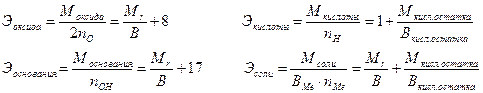 (2)
(2)
nO, nOH, nH, nMe – число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли; В – валентность, 8 – эквивалентная масса кислорода, 1 – эквивалентная масса водорода, 17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:

Затем по формуле (1) определяют эквивалентную массу.
Рисунок и описан и е прибора для определе ния эквивалента металла
Рис.1.1
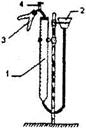
Прибор состоит из бюретки 1, соединенной резиновыми трубками с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
Реактивы и посуда.
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10 % - ный раствор соляной кислоты, металлический магний.
Практическая часть
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12мл 10%- ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25-30 см и держите на одном уровне 1 -2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. (Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1 Параметры для расчета эквивалента металла.
| m, г | P, Па | Т, К | V, мл | Р0, Па | Т0, К | V0, мл | h, Па |
Определите давление Р по барометру и температуру Т по термометру.
Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из следующей таблицы:
Таблица 1.2 Давление насыщенного водяного пара при различных температурах
| Т, К | h, Па |
Р0 - давление при нормальных условиях, равное 101325 Па;
Т0 - температура при нормальных условиях, равная 273 К.
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению Клапейрона (3):
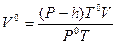
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:
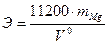
Определите теоретическое значение эквивалентной массы магния по формуле:
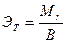
где 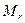 - мольная масса металла, В валентность металла.
- мольная масса металла, В валентность металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:

Указания по технике безопасности
Необходимым условием протекания опыта является герметичность всей системы. Она в основном определяется тем, насколько плотно прилегают пробки к двухколенной пробирке и бюретке. При проверке герметичности прибора во избежание порезов рук стеклом, которые могут возникнуть при чрезмерном нажиме пробки на стекло, необходимо двухколенную пробирку, пробку и бюретку держать полотенцем.
Лабораторная работа №2
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 615; Нарушение авторских прав?; Мы поможем в написании вашей работы!