
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Определение концентрации раствора
|
|
|
|
Цель работы: экспериментально определить концентрацию раствора методом объемного анализа; основываясь на коллигативных свойствах растворов, определить молекулярную массу растворенного вещества.
Теоретическая часть.
Растворы представляют собой однородную систему, состоящую из двух или больше компонентов, один из которых является растворенным веществом, а другой, как правило, взятый в большем количестве, растворителем.
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном весовом количестве или определенном объеме раствора или растворителя.
Способы выражения концентраций:
1. Молярность С М - это число молей растворенного вещества в 1 л раствора:
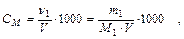
где ν - количество молей растворенного вещества;
m1 - масса растворенного вещества, г;
М1 - молярная масса растворенного вещества, г/моль;
V – объем раствора, мл.
2. Нормальность С н или N - число грамм-эквивалентов растворенного вещества в 1 л раствора:
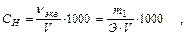
где ν экв - количество молей эквивалентов растворенного вещества;
Э - эквивалентная масса растворенного вещества, г/моль.
Согласно закону эквивалентов равные объемы одинаковой концентрации содержат одинаковое число г-эквивалентов растворенного вещества, поэтому при одинаковой нормальности объемы растворов реагирующих веществ равны. Если же эти нормальности неодинаковы, то объемы растворов обратно пропорциональны их нормальностям:
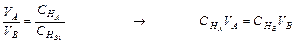
Основанный на этом метод определения концентрации растворов называется объемным анализом и сводится к измерению объемов растворов реагирующих веществ, концентрация одного из которых известна. Такое измерение производится постепенным прибавлением одного раствора к другому, до окончания реакции, которое определяется с помощью индикатора. Этот процесс называется титрованием.
3. Моляльность Ст - число молей растворенного вещества в 1000 г растворителя:

где m1 - масса растворенного вещества, г;.
m2 - масса растворителя, г
4. Мольная доля χ1 - отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора:
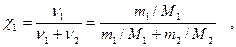
где ν1,ν2 - число молей растворенного вещества и растворителя;
М2 - молярная масса растворителя, г/моль
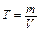
|
5. Титр Т - количество граммов растворенного вещества в 1 смЗ раствора:
6. Процентная концентрация или массовая доля ω – это количество граммов растворенного вещества в 100 г раствора:

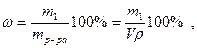
где р - плотность раствора, г/см3,
Приготовление растворов необходимой концентрации часто производится путем разбавления концентрированных растворов. Нужные весовые количества исходных жидкостей легко находятся при помощи так называемого «правила креста». Так, например, используемая в качестве электролита для аккумуляторов 25%-ная серная кислота готовится из концентрированной 96%-ной кислоты и воды 0%:

 96 25 25-0=25
96 25 25-0=25

 25
25
0 71 96-25=71
В соответствии со схемой для приготовления 25%-ной серной кислоты нужно взять 25 весовых частей 96%-ной серной кислоты и 71 весовую часть воды.
Практическая часть
0пыт1. Определение концентрации раствора кислоты.
Описание прибора:
Измерительным прибором, применяемым в объемном анализе, является бюретка, которая служит для точного определения объемов жидкостей. Бюретка заполняется раствором несколько выше нулевого деления. Открыв кран или зажим, сливают избыток раствора, доводя его уровень до нулевого деления. При наблюдении положения жидкости в бюретке глаз наблюдателя, должен находиться точно на уровне нижнего края мениска (вогнутая поверхность жидкости).
Для приготовления растворов нормальной и молярной концентрации используют мерную колбочку, в которую загружают определенное количество вещества и доливают воду до метки, содержимое колбы встряхивают.
Ход работы:
В чистую_коническую колбочку налить указанное количество миллилитров кислоты неизвестной концентрации, отмеренное с помощью цилиндра, и добавить 3-5 капель индикатора - фенолфталеина. Поставить колбочку под бюретку с раствором щелочи известной концентрации на чистый лист белой бумаги. Приливать в колбочку из бюретки небольшими порциями (приблизительно по 1 мл) раствор щелочи до появления окраски, не исчезающей при перемешивании. В растворе кислоты фенолфталеин бесцветен, поэтому при титровании щелочью необходимо уловить момент появления устойчивой окраски всего раствора от одной капли прибавляемого раствора щелочи. Появление окраски означает, что кислота полностью нейтрализована щелочью. Объем щелочи, пошедшей на титрование, записать в таблицу с точностью до 0,1 мл. Первое титрование является ориентировочным. Титрование следует повторить еще 2 раза. Взяв среднее значение объема раствора щелочи, пошедшего на титрование, рассчитать нормальность кислоты. Рассчитать массу кислоты, содержащейся в 10 мл этого раствора.
Форма записи:
| № опыта | Объем кислоты, мл | Объем щелочи, пошедшей на титрование, мл | Нормальность щелочи | Среднее значение объема щелочи, мл |
| 1. | ||||
| 2. | ||||
| 3. |
Опыт 2. Определение концентрации раствора щелочи.
Опыт выполняется аналогично опыту 2. В чистую коническую колбочку налить указанное количество миллилитров щелочи неизвестной концентрации, отмеренное с помощью цилиндра, и добавить 2-3 капли индикатора - метилоранжа. Поставить колбочку под бюретку с раствором кислоты известной концентрации на чистый лист белой бумаги. Приливать в колбочку из бюретки небольшими порциями (приблизительно по 1 мл) раствор кислоты до изменения окраски с желтой на красную от одной капли кислоты.
Изменение окраски означает, что щелочь полностью нейтрализована кислотой. Объем кислоты, пошедшей на титрование, записать в таблицу с точностью до 0,1 мл.
Первое титрование является ориентировочным. Титрование следует повторить еще 2 раза. Взяв среднее значение объема раствора кислоты, пошедшего на титрование, рассчитать нормальность щелочи. Рассчитать массу щелочи, содержащейся в 10 мл этого раствора.
Форма записи:
| № опыта | Объем щелочи, мл | Объем кислоты, пошедшей на титрование, мл | Нормальность кислоты | Среднее значение объема кислоты, мл |
| 1. | ||||
| 2. | ||||
| 3. |
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2200; Нарушение авторских прав?; Мы поможем в написании вашей работы!