
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Цель работы: проведение ряда окислительно-восстановительных реакций, составление их уравнений методом электронно-ионного баланса и определение типа реакции.
Теоретическая часть.
Окислительно-восстановительным и называются реакции, сопровождающие переходом электронов от одних атомов и ионов к другим, в результате чего меняется степень окисления элементов. При этом элемент, отдающий электроны, называется восстановителем, а элемент, который принимает электроны - окислителем.
Степенью окисления называется заряд атома, вычисленный исходя из условного предположения, что все связи в молекуле окислителя и восстановителя являются ионными.
При определении степени окисления атомов в соединениях можно руководствоваться следующими положениями:
1. Степень окисления атомов в простых веществах (например, I2, O2, S, Al, Zn и т.п.) принимается равной нулю.
2. Водород в подавляющем большинстве соединений (за исключением гидридов металлов КН, NaH, CaH2 и т.д.) проявляет степень окисления +1.
3. Кислород во всех соединениях, за исключением пероксидов, супероксидов и фторида кислорода обладает степенью окисления -2.
4. Постоянную степень окисления в соединениях имеют щелочные металлы (Li, Nа, К, Cs, Fr) +1 и щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) +2.
5. Алгебраическая сумма всех зарядов на атомах (или алгебраическая сумма произведений числа атомов на их степень окисления), входящих в состав молекулы, равна 0.
Для уравнивания окислительно-восстановительных реакций коэффициенты не подбираются, как в случае реакций ионного обмена, а вычисляются на основании уравнений электронного или электронно-ионного баланса. Проиллюстрируем оба метода на примере реакции, протекающей по схеме:
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
По методу электронного баланса вначале определяют степени окисления элементов в исходных веществах и продуктах и находят элементы, изменяющие свою степень окисления:
Na+1 Cr +3O2-2 + Br 20 + Na+1O-2H+1 ® Na2+1 Cr +6O4-2 + Na+1 Br -1 + H2+1O-2,
затем для этих элементов составляют уравнения электронного баланса:
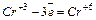 | 2 восстановитель
| 2 восстановитель
 | 3 окислитель
| 3 окислитель
Коэффициенты 2 и 3 получены исходя из непременного условия, что количество электронов, принимаемых окислителем, должно быть равно количеству электронов, отдаваемых восстановителем. Выставив найденные коэффициенты перед окислителем и восстановителем, затем уравнивают реакцию в целом:
2 NaCrO2 + 3 Br2 + 8 NaOH = 2 Na2CrO4 + 6 NaBr + 4 H2O
По методу электронно-ионного баланса уравнения электронного баланса составляют не для элементов, а для ионов или молекул, в состав которых в водных растворах входят элементы, изменяющие свою степень окисления. Для уравнивания используют находящиеся в растворе молекулы воды и ионы, определяющие характер среды (в данном случае ионы ОН-):
 | 2 восстановитель
| 2 восстановитель

 | 3 окислитель
| 3 окислитель
Коэффициенты перед окислителем и восстановителем определяются аналогично методу электронного баланса. Преимуществом метода электронно-ионного баланса является то, что одновременно определяются и коэффициенты перед моекулами воды и молекулами, определяющими характер среды (в данном случае NaОН):
2 NaCrO2 + 3 Br2 + 8 NaOH ® 2 Na2CrO4 + 6 NaBr + 4 H2O
Классификация ОВР:
а) межмолекулярные реакции, в которых окислитель и восстановитель - разные вещества:
P 0 + H N +5O3 + H2O ® H3 P +5O4 + N +2O;
б) внутримолекулярные реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся а составе одной и той же молекулы:
K N +5 O 3-2 ® K N +3O2 + O 20;
в) реакции диспропорционирования (самоокисления - самовосстановления), при которых происходит окисление и восстановление атомов одного и того же элемента в одной и той же степени окисления:
K Cl +5O3 ® K Cl-1 + K Cl+7 O4
г) реакции обратного диспропорционирования - окислитель и восстановитель – атомы одного и того же элемента в разных степенях окисления:
H2 S -2 + S +4O2 ® S 0 + H2O;
Определение продуктов окислительно-восстановительной реакции является непростой задачей, поскольку их состав зависит от концентрации реагирующих веществ, от кислотности среды и т. д. Так, например, Мn+7 в кислой среде восстанавливается до Мn+2, в нейтральной - до Мn+4 и в щелочной - до Мп+6.
Следует также учитывать, что чем более сильный восстановитель участвует в реакции, тем более глубоко восстанавливается окислитель и наоборот. Так, при реакции разбавленной азотной кислоты с малоактивными металлами (Bi, Си, Ag)oбpaзyeтcя N0, а при реакции ee с активными металлами (Zn, Mg, Ca) - N2O, N2 или NH3.
Надо также иметь в виду, что ряд элементов может проявлять целый набор различных степеней окисления. В таблице приведены возможные степени окисления для наиболее распространенных окислителей и восстановителей и соответствующие данным степеням окисления соединения.
Только окислительные свойства проявляют элементы, имеющие высшую степень окисления, только восстановительные-элементы в низшей степени окисления и свободные металлы. Элементы, имеющие промежуточную степень окисления, а также свободные неметаллы за исключением F2 могут проявлять как окислительные, так и восстановительные свойства.
Практическая часть
Общие указания по проведению опытов
Вещества, между которыми проводится реакция, берутся в одинаковых пропорциях (8-10 капель), причем, смешивание веществ следует производить в той последовательности, которая указана в задании.
Внимательно следите за внешними изменениями (изменение цвета, запаха, выделение газа или осадка) при протекании реакции и фиксируйте их. Для определения возможных продуктов воспользуйтесь таблицей. Рекомендуется начать определение возможных продуктов реакции с поиска потенциальных окислителей и восстановителей.
Оформление опытов следует начинать с написания уравнений электронно-ионного баланса, затем, просуммировав эти уравнения с учетом найденных коэффициентов, получают сокращенную ионную форму ОВР. Дополнив левую и правую часть сокращенной ионной формы фоновыми ионами, получают полную ионную форму ОВР и, наконец, объединив ионы в молекулы, - молекулярную форму ОВР.
Задания:
Опыт №1. Реакции, в которых окислителями являются элементы в высшей степени окисления:.........
| I. KMnO4 + H2SO4 + NaNO2 2.KMnO4 + H2O + NaNO2 З: KMnO4 + NaOH + NaNO2 4. KMnO4 + H2SO4 + FeSO4 5. CuCI2+ NaNO2 6. FeSO4+ H2SO4+ K2CrO4 | 7. KMnO4 + H2SO4 + Na2S
8. (NH4)2Cr2O7  9. KMnO4 + MnSO4
10. KMnO4 + KOH +Na2S2O3
11. KMnO4 + KOH +KI
12. KMnO4 + KOH +I2
9. KMnO4 + MnSO4
10. KMnO4 + KOH +Na2S2O3
11. KMnO4 + KOH +KI
12. KMnO4 + KOH +I2
|
Опыт №2. Реакции, в которых восстановителями являются элементы в низшей степени окисления или свободные металлы:
| 1. KMnO4 + H2SO4 +KI 2. KI+FeCl3 3. KI+ H2SO4 + NaNO2 4. KI+ H2SO4конц 5. Mg+ HNO3конц 6. Mg+ HNO3разб 7. K2CrO4+ H2SO4+Mg | 8. KMnO4 + H2SO4 +Mg 9. KI+ HNO3конц 10. KI+ H2SO4 + K2CrO4 11. KMnO4 + H2SO4 +Na2S 12. Na2S+I2 13. Na2S+ H2SO4 + K2CrO4 14. KMnO4 + H2SO4 +Zn |
Опыт №3. Окислительно-восстановительная двойственность элементов в промежуточной степени окисления.
| 1. KI+ H2SO4 + H2O2 2. NaNO2+ H2SO4+ K2CrO4 3. H2O2+ H2SO4+ K2CrO4 4. Na2S2O3+ NaOH +I2 5. Na2S2O3+ H2SO4 6. Na2S2O3+HCl | 7. KMnO4 + H2SO4 + H2O2 8. I2+ KOH 9. KMnO4 + H2O2 10. Na2S2O3+ KMnO4 11. Na2S2O3+ H2SO4 + K2CrO4 12. CuCI2+ Na2S2O3 |
Выводы:
В выводах по каждой реакции следует указать, какой элемент ипочему является окислителем и восстановителем, составить уравнения, электронно-ионного баланса и на их основании молекулярные уравнения ОВР и пояснить, к какому типу окислительно-восстановительных реакций относится данная реакция.
Таблица 7.1.
| Элемент | Степень окисления | Соединение или ион | Внешние признаки |
| Азот | +5 | NO3- | Бесцветный раствор |
| +4 | NО2 ↑ | Бурый газ с резким запахом | |
| +3 | NО2-(KNО2,...) | Бесцветный раствор | |
| +2 | NO↑ | Бесцветный газ с резким запахом | |
| + 1 | N2O↑ | Бесцветный газ со слабым наркотическим действием | |
| N2↑ | Бесцветный газ без запаха | ||
| -3 | NH3 или NH4+ (NH4NO3..) | Бесцветный газ с резким запахом или бесцветный раствор | |
| Сера | -2 | H2S↑, или S2- (Na2S...) | Бесцветный газ или раствор с запахом тухлых лиц |
| S↓ | Осадок или взвесь белого цвета | ||
| +2 | S2O32- (Na2S2O3.,.) | Бесцветный раствор | |
| +4 | SO2↑, SО32- (Na2SO3..) | Бесцветный газ с резким запахом или бесцветный раствор | |
| +6 | SO42- (Na2SO4...) | Бесцветный раствор | |
| Марганец | +7 | MnO4-(KMnО4...) | Малиновый раствор |
| +6 | MnO42- (K2MnО4...) | Зеленый или сине-зеленый раствор | |
| +4 | MnO2 | Бурый оcадок или взвесь | |
| +2 | Mn2+ (MnSO4..) | Бесцветный раствор | |
| Хром | +6 | CrO42-_ (K2CrO4...), Сr2О72- (К2Сr2О7...) | Желтый раствор Оранжевый раствор |
| +3 | Cr3+ (CrCl3, Cr2(SO4)3...) | Зеленый или фиолетово-голубой раствор | |
| Железо | +3 | Fe3+ (Fe2(SO4)3,...) | Желтоватый раствор |
| +2 | Fe2+ (FeCl2, FeSO4...) | Очень бледный желтый или зеленоватый раствор | |
| Медь | +2 | Cu2+ (CuCl2,...) | Голубой раствор |
| +1 | Cu1+ (CuCl,...) | Зеленый раствор | |
| Иод | +5 | JO3- (KJO3, NaJO3..) | Бесцветный раствор |
| + 1 | JO-(KJO,NaJO...) | Бесцветный раствор | |
| J2 | Бурый раствор с характерным запахом или темно-фиолетовые кристаллы | ||
| -1 | J- (KJ. NaJ...) | Очень бледно-желтый (почти бесцветный) раствор | |
| Кислород | O2↑ | Бесцветный газ без запаха | |
| -1 | H2O2 | Бесцветная жидкость | |
| -2 | h2o, oh- | Бесцветная жидкость |
Лабораторная работа №8
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1213; Нарушение авторских прав?; Мы поможем в написании вашей работы!