
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость газов в нефти и в воде
|
|
|
|
От количества растворенного в пластовой нефти газа зависят все ее важнейшие свойства: вязкость, сжимаемость, термическое расширение, плотность и т. д.
Сложность состава нефти и значительные пределы изменения пластовых давлений и температур затрудняют применение термодинамических уравнений для расчетов газонасыщенности нефти при высоких давлениях. Поэтому газонасыщенность нефтей при различных давлениях и температурах обычно определяют по экспериментальным данным.
При небольших давлениях и температурах растворимость газов в нефти практически подчиняется закону Генри — количество газа Vг, растворенного при данной температуре в объеме Vж жидкости, пропорционально давлению р газа над поверхностью: Vг =apVж, (III.82)
где a — коэффициент растворимости газа [м2/Н],  (111.83)
(111.83)
Из формулы (111.83) следует, что коэффициент растворимости учитывает количество газа, растворяющегося в единице объема жидкости при увеличении давления на единицу.
Коэффициент растворимости реальных газов — величина не постоянная и зависит от рода жидкости и газа, от давления, температуры и от других факторов, которые сопутствуют растворению газа в жидкости.
Получение зависимостей концентрации газа в жидкости от давления затрудняется не только вследствие отклонения реальных газов от законов идеального, но также и потому, что в растворе реальный газ приобретает специфические свойства. Внешнее выражение этих свойств — увеличение объема раствора при введении в него газа. Повышение объема влияет на концентрацию газа в жидкости. Приращение объема раствора определяется количеством растворенного газа, свойствами жидкости и газа, температурой и давлением. Увеличение объема жидкости обычно характеризуется кажущимся удельным объемом растворенного газа в жидкой фазе v, т. е. приращением объема жидкости при растворении в ней 1 кг газа: 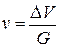
где G — масса растворенного газа.
Смысл понятия «кажущийся удельный объем» заключается в том, что приращение объема DV жидкости (нефти) не отражает истинного объема растворенного газа в нефти, а является результатом взаимодействия молекулярных сил растворенного газа и жидкости. В химической термодинамике величину v называют парциальным молярным объемом.
 При растворении газов в нефти коэффициент растворимости газов в зависимости от давления может увеличиваться и уменьшаться (рис. III.13).
При растворении газов в нефти коэффициент растворимости газов в зависимости от давления может увеличиваться и уменьшаться (рис. III.13).
Рис. III. 13. Изотермы растворимости газов в различных нефтях при температуре 50 °С (по Т. П. Сафроновой и Т. П. Жузе). Нефть месторождений: 1 - Ромашкинского (Р); 2 - Сураханского (С); 3 - Небитдагского (Я); 4 - Туймазинского (Т)
Перегиб кривой растворимости и возрастание коэффициента a некоторых газов происходят в связи с увеличением объема жидкости и влиянием этого процесса на концентрацию газа в ней. Приращение объема раствора и ее интенсивность зависят от количества растворенного газа, свойств жидкостей и газов и их состава. Наконец, значительное влияние на растворимость газов оказывают процессы обратного испарения (об этом см. гл. IV).
Различные компоненты нефтяного газа обладают неодинаковой растворимостью, причем с увеличением молекулярной массы газа коэффициент растворимости его возрастает. Особенно плохо растворяется азот. Из рис. III.13 следует, что растворимость газов в нефти, помимо давления, температуры и природы газа, зависит также от свойств нефти. Установлено, что разница в абсолютных значениях растворимости газов в исследованных нефтях и характер изотерм растворимости связаны с различным фракционным и углеводородным составом нефтей. Растворимость газов увеличивается с повышением содержания в нефти парафиновых углеводородов (нефти Туймазинского и Ромашкинского месторождений содержат во фракциях, выкипающих до 300 °С, около 52 % парафиновых углеводородов; в нефтях Сураханского и Небитдагского месторождений их содержится 42—43%). Установлено также, что при высоком содержании ароматических углеводородов в нефти ухудшается растворимость в ней газов.
Форма изотерм растворимости для различных газов также не одинакова. Для плохо растворимых газов (азот, метан) они характеризуются пологим подъемом, почти равномерным во всем интервале изменения давления (т. е. малорастворимые газы лучше подчиняются закону Генри, чем хорошо растворимые). Изотермы хорошо растворимых газов (СО2, С2Н6, С3Н8) характеризуются резким подъемом до определенных давлений, а затем они выполаживаются. Последнее объясняется обратными процессами растворения компонентов нефти в сжатом газе при высоких давлениях. Это явление в ряду углеводородных газов усиливается с ростом молекулярной массы газа. Для азота он незначителен, а если метан растворяется в нефти, обратное испарение его наблюдается лишь при очень высоких давлениях (о природе процессов обратного испарения см. гл. IV).
Из рис. III.13 также следует, что на растворимость газов в нефти природа газа влияет в большей степени, чем состав нефти.
Коэффициент растворимости нефтяных газов изменяется в широких пределах и достигает (4—5)10-5 м3/(м3×Па).
Углеводородные газы хуже растворяются в нефти с повышением температуры. Так, например, в нефти Ромашкинского месторождения при давлении 15 МПа и температуре t=40°С в 1 м3 нефти растворяется 59 м3 газа, а при температуре t= 60 °С - 53м3.
Установлено, что количество растворяющегося или выделяющегося из нефти газа при одних и тех же условиях зависит еще от характера процесса — протекает ли он контактно или дифференциально. Контактными (или одноступенчатыми) принято называть такие процессы, при которых весь выделяющийся газ находится в контакте с нефтью. При дифференциальном процессе выделяющийся из раствора газ непрерывно отводится из системы. При этом, очевидно, и состав нефтегазовой смеси в процессе разгазирования непрерывно изменяется. Строгое соблюдение условий дифференциального дегазирования в лабораторных условиях затруднено, и обычно оно заменяется ступенчатым (или многократным) разгазированием. В этом случае количество выделившегося из нефти газа измеряется порциями по мере снижения давления в смеси и отвода выделившегося газа.
Если процесс дифференциальный, то количество остающегося в растворенном состоянии газа при одинаковых давлениях будет больше, чем при контактном. Это связано с преимущественным переходом в паровую фазу метана в начале процесса дегазации. С удалением его из системы увеличивается, содержание тяжелых углеводородов в составе оставшихся в системе газов. Вследствие этого повышается растворимость их в нефти. В промысловых условиях протекают и контактные, и дифференциальные процессы дегазирования. Например, в начальные периоды снижения давления ниже точки насыщения, когда газ в пласте еще неподвижен относительно нефти, процесс более походит на контактное дегазирование. В последующие периоды, когда насыщенность пор газом увеличивается, он по мере выделения из нефти быстрее движется к забоям скважин и процесс дегазирования напоминает дифференциальный.
Представление о количестве газа, выделившегося из нефти при снижении давления, дают кривые разгазирования (рис. III. 14). Большая часть кривых разгазирования нефтей обычно похожа на кривую 1.
 Рис. III.14. Кривые разгазирования нефти Новодмитриевского месторождения (по данным ВНИИ) 1 - плотность 809 кг/м3 при t=20 °C; 2 - плотность 809 кг/м3 при t=104 °С; 3 - плотность 824 кг/м3 при t=105 °C
Рис. III.14. Кривые разгазирования нефти Новодмитриевского месторождения (по данным ВНИИ) 1 - плотность 809 кг/м3 при t=20 °C; 2 - плотность 809 кг/м3 при t=104 °С; 3 - плотность 824 кг/м3 при t=105 °C
Коэффициентом разгазирования принято называть количество газа, выделяющегося из единицы объема нефти при снижении давления на единицу. Обычно по мере снижения давления коэффициент разгазирования увеличивается, но закономерность эта не всегда соблюдается. Иногда этот коэффициент при высоких давлениях оказывается больше, чем при низких. В области очень высоких температур и давлений коэффициент разгазирования возрастает в связи с явлениями обратного испарения.
 В последние годы значительно возросли глубины залегания пластов, вовлекаемых в разработку. Проводились исследования свойств нефтей при давлениях до 100 МПа. На рис. III.15 приведены изотермы растворимости газа с относительной плотностью 0,68 в нефти.(рн=865 кг/м3).
В последние годы значительно возросли глубины залегания пластов, вовлекаемых в разработку. Проводились исследования свойств нефтей при давлениях до 100 МПа. На рис. III.15 приведены изотермы растворимости газа с относительной плотностью 0,68 в нефти.(рн=865 кг/м3).
Рис. III. 15. Изотермы растворимости газа относительной плотностью 0,68 в нефти (рн=865 кг/м3) Температура в °С: 1- 69; 2 — 95; 3 — 127
Как следует из рис. III. 15, в области высоких давлений зависимость газонасыщенности нефти от давления может быть принята за линейную. На основании опытных данных Н. А. Тривус и А. К. Ахмедов получили следующее уравнение для вычисления количества газа (плотностью 0,62), растворенного при давлении р и температуре t в нефтях месторождений Азербайджана с плотностью рн:
Q = [9×10-9(t—40)р] + [756—2,6(t—40) + 1,2×10-5p](0,93 -рн), (II1.84)
где р — давление, Па; t — температура, °С; рн — плотность нефти, г/см3.
Растворимость углеводородных газов в воде незначительна. Однако следует учитывать, что площадь контакта газовой залежи с подстилающей водой может быть большой, а давление в пласте достигать 50—70 МПа. В этих условиях значительные количества газа в воде могут находиться в растворенном состоянии.
Процессы растворения и фазовые переходы углеводородов в водных системах, по-видимому, играли важную роль при миграции углеводородов и формировании газовых залежей. Поэтому вопросы растворимости углеводородов в воде привлекают внимание исследователей.
Содержание растворенного газа в воде можно выразить в виде молярных долей  (111.85)
(111.85)
или же в виде объема газового компонента, растворенного в единице массы, или объема Vв воды  ;
;  (III.86)
(III.86)
В этих формулах ni и nв — соответственно число молей (грамм-молекул) i- то компонента в водном растворе и число молей воды; Vi — объемы газового компонента, приведенного к нормальным условиям; G — масса воды в (г), в которой растворен компонент.
Величины N'i и bi связаны соотношением
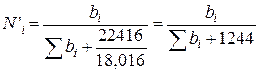 , (111.87)
, (111.87)
где 22416 — объем моля идеального газа при нормальных условиях; 18,016 — молекулярная масса воды.
Значение Sbi для большинства газов (за исключением углекислого газа и сероводорода) значительно меньше, чем 124,4 и поэтому можно принять
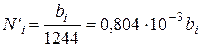 (111.88)
(111.88)
Для выражения растворимости газа в воде используется также константа равновесия 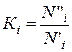
 (III.89)
(III.89)
где N"i и N'i — молярные доли компонента в газовой и жидкой фазах.
 Законы растворимости газов в воде отличаются некоторыми особенностями. Как уже упоминалось, растворимость углеводородных (неполярных) газов в воде по сравнению с их растворимостью в органических жидкостях весьма мала (рис. III.16). С увеличением температуры растворимость газов вначале уменьшается, а затем возрастает, пройдя через минимум. Причем температура минимальной растворимости различных газов возрастает с увеличением размера молекулы газа [17]. Температура минимальной растворимости газов зависит от давления (рис. III.17). С повышением минерализации ухудшается растворимость газов в воде. По данным ВНИИ, растворимость азота в дистиллированной воде, например, при р= 15,0 МПа и t=25°C составляет около 1,52 м3/м3, а в четырехмолярном растворе NaCl лишь около 0,48 м3/м3, т. е. более чем в 3 раза меньше.
Законы растворимости газов в воде отличаются некоторыми особенностями. Как уже упоминалось, растворимость углеводородных (неполярных) газов в воде по сравнению с их растворимостью в органических жидкостях весьма мала (рис. III.16). С увеличением температуры растворимость газов вначале уменьшается, а затем возрастает, пройдя через минимум. Причем температура минимальной растворимости различных газов возрастает с увеличением размера молекулы газа [17]. Температура минимальной растворимости газов зависит от давления (рис. III.17). С повышением минерализации ухудшается растворимость газов в воде. По данным ВНИИ, растворимость азота в дистиллированной воде, например, при р= 15,0 МПа и t=25°C составляет около 1,52 м3/м3, а в четырехмолярном растворе NaCl лишь около 0,48 м3/м3, т. е. более чем в 3 раза меньше.
Рис. III.16. Кривые растворимости газа в чистой и соленой воде при различных температурах и давлениях (по данным ВНИИ) 1, 2 - дистиллированная вода; 3, 4 - раствор NaCl
 Рис. III.17. Изменение температуры минимальной растворимости этана в зависимости от давления при О °С
Рис. III.17. Изменение температуры минимальной растворимости этана в зависимости от давления при О °С
Растворимость различных газов в воде определяется по соотношению (111.89). Константы равновесия компонентов природного газа приведены в работе [17]. Они не зависят от состава и являются функцией только температуры и давления. (В общем случае константы равновесия компонентов и в водных системах также зависят от состава газа. Однако естественный газ состоит в основном из метана и влиянием других составляющих на перераспределение компонентов пренебрегают).
Влияние содержащихся в пластовой воде солей на растворимость природного газа учитывается уравнением Сеченова N'*i = N'i× 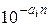 или b*i =
или b*i = 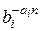 , (II1.90)
, (II1.90)
где а, — коэффициент Сеченова, характеризующий влияние данной соли на растворимость i-го газового компонента; n— концентрация растворенной в воде соли, г-экв/л; N'*i — молярная доля газового компонента в воде, содержащей растворенные соли.
Согласно уравнению Сеченова K'i=Ki×10ain (III.91)
Здесь К'i — константа равновесия в минерализованной воде.
 На рис. III..18 приведены значения коэффициентов Сеченова для основных составляющих природных газов. Считается, что значение давления на коэффициент Сеченова влияет незначительно и поэтому при расчетах можно использовать коэффициенты Сеченова, определенные для атмосферных условий. Степень минерализации начинает заметно влиять на коэффициент Сеченова при концентрации солей, превышающей 0,5 моль/л. Влияние состава солей, давления и других факторов на коэффициент Сеченова изучено недостаточно и обычно поправки на эти факторы не учитываются.
На рис. III..18 приведены значения коэффициентов Сеченова для основных составляющих природных газов. Считается, что значение давления на коэффициент Сеченова влияет незначительно и поэтому при расчетах можно использовать коэффициенты Сеченова, определенные для атмосферных условий. Степень минерализации начинает заметно влиять на коэффициент Сеченова при концентрации солей, превышающей 0,5 моль/л. Влияние состава солей, давления и других факторов на коэффициент Сеченова изучено недостаточно и обычно поправки на эти факторы не учитываются.
Рис. III.18. Изменение коэффициента Сеченова для основных составляющих природных газов
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3322; Нарушение авторских прав?; Мы поможем в написании вашей работы!