
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение изобарной молярной теплоемкости природных газов
|
|
|
|
Удельная теплоемкость — количество теплоты, сообщаемой единице массы вещества, чтобы изменить его температуру на один градус. Для газов различают изобарную ср и изохорную сv удельные теплоемкости,
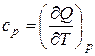
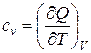 Ошибка! Ошибка связи. (Ш.59)
Ошибка! Ошибка связи. (Ш.59)
где индексы у скобок означают давление р = const и объем V= const.
Согласно первому началу термодинамики имеем dQ=dt—Vdp, (III. 60)
где Q — количество теплоты; V — объем системы; i— энтальпия (теплосодержание). di = cpdT +  . (III.61)
. (III.61)
При изобарном процессе (р = const) изменение количества теплоты системы равно изменению ее энтальпии dQ = di = CpиdT (II1.62)
или 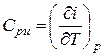 (Ш-63)
(Ш-63)
Изобарная молярная теплоемкость идеальных газов Сри зависит от температуры. Зависимость молярной теплоемкости компонентов природных газов при атмосферном давлении от температуры приближенно можно выразить формулой
Сри = 0,523 (8,36+0,00892t) 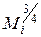 , кДж/(кмоль-К), (III.64)
, кДж/(кмоль-К), (III.64)
где Mi — молекулярная масса углеводорода, являющегося компонентом природного газа (от метана до гептана включительно)
Погрешность расчетов по формуле (III. 64) для углеводородов CH4-C5H12 в интервале температур минус 40 °С плюс 120 ОС не превышает 5%, для углеводородов С6Н14—С7Н16 в том же интервале температур не превышает 10 %.
Изобарная молярная теплоемкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоемкости углеводорода с одинаковой молекулярной массой при одинаковой температуре.
Например, изобарная молярная теплоемкость CO2(Cри=44) равна половине молярной теплоемкости пропана С3Н8 (Сри=44), которая рассчитывается по формуле (111.64).
Теплоемкость смесей газов определяется по правилу аддитивности(II1.65)
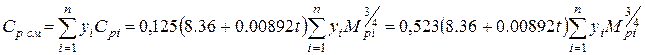
где yi - молярная доля i -ro компонента в смеси; cpi — изобарная молярная теплоемкость i-ro компонента.
Изобарная молярная теплоемкость реальных природных газов зависит от давления и температуры Ср = Сри(t) + DСр(р, t), (Ш.66)
где DСр(р, t) —изотермическая поправка теплоемкости на давление (рис. III.9).
Изобарную молярную теплоемкость природного газа можно рассчитать и по формуле, предложенной Л. М. Гухманом и Т. В. Нагаревой:
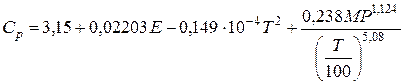 (III.67)
(III.67)
При решении задач, связанных с добычей, транспортом, хранением и переработкой природных газов, наиболее употребительны двухконстантные уравнения состояния и восьмиконстантные.
 Рис. III.9. Зависимость изотермической поправки изобарной мольной теплоемкости DСр(р, t) от приведенных абсолютных давления рпр и температуры Тпр
Рис. III.9. Зависимость изотермической поправки изобарной мольной теплоемкости DСр(р, t) от приведенных абсолютных давления рпр и температуры Тпр
Последней, наиболее удачной модификацией двухконстантного уравнения состояния природных газов, предложенной в 1975 г., является уравнение состояния Пенга — Робинсона
 (III.68)
(III.68)
где V —молярный объем; а(Т), b — коэффициенты уравнения, определяемые критическими параметрами вещества (коэффициент а(Т) —фракция температуры).
Уравнение состояния Пенга—Робинсона, записанное относительно коэффициента сверхсжимаемости z, имеет вид z3-(1-В)z2+(А-3В2-2В)z-(АВ—В2-B3)=0, (69)
где  ;
; 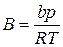 (III.70)
(III.70)
Уравнение (III.69) имеет один или три действительных корня. Если смесь находится в двухфазном состоянии, то больший корень относится к паровой фазе, а наименьший положительный корень — к жидкой фазе.
При критических условиях (zкp = 0,307)
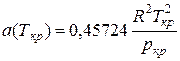 ;
; 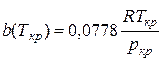 (Ш.71)
(Ш.71)
При температурах, отличных от критической,
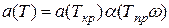 ;
;  , (111.72)
, (111.72)
где 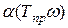 — безразмерная функция приведенной температуры Тпр и ацентрического фактора w; при критической температуре a=1.
— безразмерная функция приведенной температуры Тпр и ацентрического фактора w; при критической температуре a=1.
Для всех веществ зависимость между a0,5 и Т0,5пр может быть аппроксимирована уравнением прямой a0,5 =1+m(1- Т0,5пр), (III.73)
где коэффициент m, определяющий угол наклона прямой к оси Т0,5пр, является функцией ацентрического фактора w: m=0,37464+1,5422bw—0,26992w2. (III.74)
При использовании уравнения Пенга—Робинсона для расчета термодинамических и физических свойств многокомпонентных смесей коэффициенты аcм(Т) и bсм вычисляют по следующим формулам:
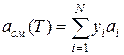
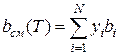 (111.75)
(111.75)
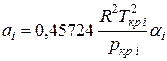
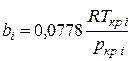 (III.76).
(III.76).
Отклонение теплофизических свойств реальных природных газов от идеальных можно определить с использованием уравнения состояния Пенга — Робинсона.
Отклонение энтальпии реального газа
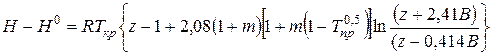 (III.77)
(III.77)
 где Н° — энтальпия идеального газа.
где Н° — энтальпия идеального газа.
Энтальпийная диаграмма природного газа изображена на рис. III.10.
Рис. III.10. Энтальпийная диаграмма природного газа
Отклонение молярной изобарной теплоемкости реального газа
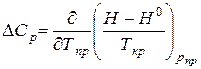 . (III_78)
. (III_78)
Зависимость DСр от рпр и Тпр изображена на рис. III.9
Разность изобарной и изохронной молярных теплоемкостей реального газа
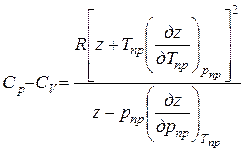 (79)
(79)
где  (80)
(80)
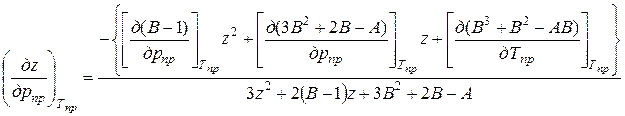 (81)
(81)
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3819; Нарушение авторских прав?; Мы поможем в написании вашей работы!