
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Схемы фазовых превращений углеводородов
|
|
|
|
В процессе разработки месторождений в пластах непрерывно изменяются давление, количественное соотношение газа и нефти, а иногда и температура. Это сопровождается непрерывными изменениями состава газовой и жидкой фаз и переходом различных углеводородов из одной фазы в другую.
Особо интенсивные процессы таких превращений происходят при движении нефти по стволу скважины от забоя к устью. Вследствие быстрого падения давления из нефти выделяется значительное количество газа и около устья поток превращается иногда в тонкодисперсную взвесь микрокапель нефти в газовой среде.
Точно так же и дальнейшее движение нефти и газа к потребителю сопровождается непрерывными фазовыми превращениями. Например, газ, содержащий значительное количество бензиновых фракций в парообразном состоянии, проходит специальную обработку, при которой из него извлекается газовый бензин; из нефти, уже не содержащей газ, стараются извлечь и уловить наиболее летучие жидкие фракции для уменьшения потерь нефтепродуктов от испарения при хранении их в резервуарах и т. д.
Закономерности фазовых переходов и фазовое состояние газонефтяных смесей при различных условиях необходимо знать для решения многих задач. Например, с учетом закономерностей фазовых изменений углеводородов составляется проект разработки газоконденсатных месторождений. Теорией фазовых изменений пользуются для расчета количества и состава газа, выделяющегося из нефти при различных давлениях и температурах, количества и состава бензиновых фракций, содержащихся в газе и т. д.
Схема фазовых превращении однокомпонентных систем
 Рис. IV.I. Диаграмма фазового состояния чистого этана
Рис. IV.I. Диаграмма фазового состояния чистого этана
Известно, что углеводородные газы изменяют объем подобно всем индивидуальным веществам в зависимости от температуры и давления в соответствии с графиками, приведенными на рис. IV. 1, а. Каждая из кривых соответствует фазовым изменениям однокомпонентного газа при постоянной температуре и имеет три участка. Справа от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок — двухфазной газожидкостной области и левый участок — жидкой фазе. Отрезок пунктирной кривой вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума — кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением давления и температуры к их критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара" будет непрерывно возрастать.
Для изотермических фазовых превращений однокомпонентных газов характерно постоянство давления в двухфазной области, т. е. после начала конденсации газа дальнейшее превращение его в жидкость с уменьшением объема системы происходит при постоянном давлении до тех пор, пока весь газ не превратится в конденсат.
Точно так же со снижением давления после начала парообразования дальнейшее кипение (испарение) жидкой фазы происходит при постоянном давлении.
Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара этой жидкости.
Фазовые превращения углеводородов можно представить также в координатах давление р — температура Т (рис. IV.1,б). Для однокомпонентной системы кривая давления насыщенного пара на графике давление — температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах, значения которых не располагаются на этой кривой, вещество находится в однофазном состоянии — в жидком, если при данной температуре давление выше кривой давления насыщенного пара; если при той же температуре давление ниже давления насыщенного пара, вещество находится в паровой или газовой фазе в ненасыщенном состоянии.
Фазовая диаграмма индивидуальных углеводородов в координатах давление — температура ограничивается критической точкой С. Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых еще могут существовать две фазы одновременно. Критические давления и температуры основных компонентов природного газа приведены в табл. III.5.
Из рис. IV.1, б видно, что путем соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Действительно, газ, характеризующийся параметрами в точке А, можно путем изобарического нагрева довести до температуры в точке В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область (точка D), расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно и разделения углеводорода на фазы не произойдет. При дальнейшем охлаждении системы (от точки D до точки Е), а затем и при снижении давления до значения в точке F вещество приобретает свойства жидкости, минуя область двухфазного состояния вещества.
Значительно сложнее закономерности фазовых переходов двух и многокомпонентных систем.
Схема фазовых превращений двух и многокомпонентных систем
С появлением в системе двух компонентов и более в закономерностях фазовых изменений возникают свои особенности. В качестве примера на рис. IV.2, а приведена зависимость объем — давление для смеси пентана и гептана с массовой долей последнего 52,4 %. Зона вправо от пунктирной линии (кривой точек конденсации) — область, чистого газа, в которой изотермы двух- и многокомпонентных систем аналогичны изотермам чистых компонентов. Влево от кривой точек парообразования изотермы жидкой фазы круто возрастают с уменьшением объема, и они также аналогичны изотермам области жидкости чистых компонентов. В двухфазной же области двух- и многокомпонентных систем имеются значительные изменения. Было показано (см. рис. IV.1), что в области двухфазного состояния чистых углеводородов изотермы характеризуются горизонтальными линиями, т. е. давление не изменялось до полной конденсации газа. Для двух- и многокомпонентных систем, как это следует из рис. IV.2, а, давление в процессе сжатия в двухфазной области не остается постоянным, и для конденсации газа необходимо повышать его для полного превращения газовой фазы в жидкость. Поэтому давление точки парообразования (кипения) для двух- и многокомпонентной смеси выше точек давления начала конденсации. В соответствии с этим не одинаков и состав жидкой и газовой фаз в точках парообразования и конденсации. Вскоре, после начала конденсации газа, состав последнего еще близок к составу всей системы. Точно так же вблизи точки парообразования состав жидкой фазы близок к составу исходной смеси. В двухфазной же области состав жидкой и газовой фаз отличен от состава исходной смеси и он непрерывно изменяется в соответствии с давлением и объемом системы.
 Рис. IV.2. Диаграммы фазового состояния двухкомпонентных систем. а — зависимость давление - удельный объем для смеси н-пентана и н-гептана, содержащей 52,4% н-гептана; б — диаграммы давление — температура для смесей этана с н-гептаном (точки С', С" и С"' — критические точки смесей, содержащих соответственно 90,22, 50,25 и 9,8 % этана); 1 — линия точек начала парообразования; 2 — линия точек росы
Рис. IV.2. Диаграммы фазового состояния двухкомпонентных систем. а — зависимость давление - удельный объем для смеси н-пентана и н-гептана, содержащей 52,4% н-гептана; б — диаграммы давление — температура для смесей этана с н-гептаном (точки С', С" и С"' — критические точки смесей, содержащих соответственно 90,22, 50,25 и 9,8 % этана); 1 — линия точек начала парообразования; 2 — линия точек росы
Бинарные и многокомпонентные системы также имеют свои особенности и в области, лежащей вблизи критических давлений и температур. Критическая точка чистых веществ (или однокомпонентных систем) характеризуется самыми высокими давлениями и температурой, выше которых невозможно одновременно существование двух фаз — жидкой и газообразной. В бинарных и многокомпонентных системах критическая точка характеризуется лишь одинаково интенсивными свойствами газовых и жидких фаз. При этом в зоне пересечения кривых точек конденсации и парообразования образуется область, в которой могут существовать две фазы даже при температурах и давлениях, превышающих критические значения.
С появлением в системе второго компонента большие различия появляются также в диаграммах давление — температура. Кривые точек начала кипения и точек росы не совпадают и образуют фазовую диаграмму, на вид которой, кроме температуры и давления, влияет исходный состав смеси. Крайние левая и правая кривые на диаграмме (рис. IV.2, б) соответствуют давлениям насыщенного пара для чистых компонентов — этана и н-пентана с критическими точками С2 и С7. Между ними расположены фазовые диаграммы смесей этана с н-пентаном с массовой долей этана 90,22, 50,25 и 9,8 % с соответствующими критическими точками С', С" и С'". Пунктирная линия представляет собой огибающую критических точек системы этан — н-пентан. Линии А1С', А2С" и А3С'" — линии точек начала кипения рассматриваемых смесей (выше и слева от них смесь находится в жидком состоянии), В1С', В2С" и B3C'" — линии точек росы соответствующих смесей. Ниже и справа от этих линий смесь находится в газообразном состоянии. Между линиями точек начала кипения и точек росы располагается двухфазная область. Из рис. IV.2, б видно, что с увеличением содержания н-гептана в системе критическая точка, располагающаяся вначале слева от максимальных значений давления и температуры, при которых две фазы могут существовать в равновесии, сдвигается вправо от нее. Кривые же точек росы и начала кипения при этом приближаются к кривой давления насыщенного пара, преобладающего в смеси компонента — н-гептана. Аналогично изменяются также критические температуры и давления при изменении состава смеси.
Критическая температура различных смесей находится между критическими температурами компонентов. По имеющимся экспериментальным данным, для ее вычисления можно использовать свойство аддитивности (расчетные значения критических температур при этом получаются более близкими к действительным при выражении состава в процентах по массе, а не в молярных).
Критическое же давление смеси обычно выше, чем критическое давление чистых компонентов, кроме тех случаев, когда в смеси один из компонентов содержится в значительном количестве (т. е. правило аддитивности для вычисления ркр смеси нельзя применять). Отклонение фактического значения ркр от вычисленного критического давления по правилу аддитивности возрастает с увеличением разницы между молекулярными массами чистых компонентов. Наибольшее критическое давление обычно наблюдается у смеси с близким массовым содержанием обоих компонентов.
Как видно из рис. IV.2, б, размеры двухфазной области также зависят от состава смеси — они возрастают по мере того, как в составе смеси распределение между компонентами становится более равномерным.
В связи со сложностью состава конденсатных систем и значительным преобладанием метана в смеси закономерности фазовых переходов, для упрощения изучают обычно на бинарных смесях отдельных компонентов. При этом многокомпонентная смесь условно приводится к бинарной (или тройной системе), основным компонентом которой является метан, а вторым и третьим — остальные компоненты. Полученные результаты далее считают действительными для многокомпонентных углеводородных смесей. Допустимость такого метода изучения фазовых переходов углеводородных смесей доказана специальными исследованиями.
 Рис. IV.3. Фазовая диаграмма зависимости давление — состав для бинарной системы при постоянной температуре (изотерма фазовых равновесий), 1 — кривая точек конденсации; 2 — кривая точек преобразования; 3 — двухфазная область; 4 — жидкость; 5 — газ
Рис. IV.3. Фазовая диаграмма зависимости давление — состав для бинарной системы при постоянной температуре (изотерма фазовых равновесий), 1 — кривая точек конденсации; 2 — кривая точек преобразования; 3 — двухфазная область; 4 — жидкость; 5 — газ
Для иллюстрации влияния состава углеводородов на фазовое состояние бинарных смесей при различных значениях температуры рассмотрим сначала схематическую фазовую диаграмму зависимости давление — состав для бинарной смеси (рис. IV.3). Составы сосуществующих газовой и жидкой фаз на этих кривых определяются в конечных точках отрезков постоянного давления. Бинарная система с молярной долей более летучего компонента nо при изотермическом сжатии начинает конденсироваться в точке Д. При этом состав жидкой фазы будет характеризоваться молярной долей легкого компонента nрж.
При давлении рi содержание легкого компонента в газовой фазе будет nгi, а в жидкой — nжi. В точке В, соответствующей концу процесса конденсации, в последних следах газовой фазы молярная доля легкого компонента cоставит nгв.
Относительное количество углеводородов в газовой V и жидкой L фазах при давлении pi составит  ,
, 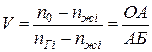 .
.
 Диаграмма, приведенная на рис. IV.3, составлена для давления и температуры ниже критических для обоих компонентов. В других условиях диаграмма не может включать всего диапазона изменения концентрации. Если температура системы выше критической для легкого компонента и ниже, чем критическая температура второго компонента, в области n' = 1 кривые, ограничивающие двухфазную область, отсутствуют (рис. IV.4). Последняя возникает, когда концентрация более тяжелого компонента в системе превысит значение (1—n'). При концентрациях более летучего компонента меньших, чем n', смысл диаграммы, приведенной на рис. IV.4, аналогичен диаграмме на рис. IV.3.
Диаграмма, приведенная на рис. IV.3, составлена для давления и температуры ниже критических для обоих компонентов. В других условиях диаграмма не может включать всего диапазона изменения концентрации. Если температура системы выше критической для легкого компонента и ниже, чем критическая температура второго компонента, в области n' = 1 кривые, ограничивающие двухфазную область, отсутствуют (рис. IV.4). Последняя возникает, когда концентрация более тяжелого компонента в системе превысит значение (1—n'). При концентрациях более летучего компонента меньших, чем n', смысл диаграммы, приведенной на рис. IV.4, аналогичен диаграмме на рис. IV.3.
Рис. IV.4. Фазовая диаграмма зависимости давление — концентрация для бинарной системы при температуре в интервале между критическими температурами компонентов. 1, 2 — кривые точек конденсации и парообразования; 3 — двухфазная область; С — критическая точка
 Рис. IV.5. Изотермы фазовых равновесий метана с парафиновыми углеводородами нормального строения при t=80 °С (по А. С. Великовскому и Я. Д. Саввиной)
Рис. IV.5. Изотермы фазовых равновесий метана с парафиновыми углеводородами нормального строения при t=80 °С (по А. С. Великовскому и Я. Д. Саввиной)
Для иллюстрации влияния на фазовые состояния давления, температуры и состава конкретных углеводородов рассмотрим поведение их бинарных смесей с метаном. На рис. IV.5 изображены диаграммы равновесных составов газовой и жидкой фаз смесей метана с парафиновыми углеводородами нормального строения для температуры 80 °С в координатах давление — состав системы. Смысл графиков, приведенных на рис. IV.5, такой же, как и на рис. IV.4. Здесь кривая точек начала кипения (левая ветвь) и кривая точек начала конденсации (правая ветвь) соединяются в критической точке. Между ними заключена область двухфазного состояния. Левее и выше кривой точек начала кипения расположена область жидкого состояния системы, а правее и ниже кривой точек росы — область парообразного состояния. Как было упомянуто, кривые представляют собой изотермы и, следовательно, точки, лежащие на одной горизонтали и принадлежащие линиям начала кипения и конденсации, имеют одинаковые давления и температуру. Составы в этих точках аналогичны составам сосуществующих фаз (жидкой и газообразной). Например, для системы метан — С7 имеем: при давлении 20МПа и t = 80 °С в составе жидкой фазы будет 0,63 молярной доли метана и 0,37 молярной доли С7 в сосуществующем с этой жидкой фазой газе будет содержаться 0,93 молярной доли метана и 0,07 молярной доли С7.
Из рис. IV.5 следует, что с увеличением молекулярной массы углеводорода (т. е. чем выше температура кипения) требуется большее давление для перевода его в газообразное состояние в смеси с метаном. Например, при давлении 19,5 МПа и t = 80 °С в газообразное состояние в смеси с метаном переходит 22 % гексана (С6) или 2% декана (С10). С понижением температуры задерживается переход углеводородов в газовое состояние в смеси с метаном. По данным Я. Д. Саввиной и А. С. Великовского, при давлении 19,5 МПа и температуре 40 °С в газовое состояние в смеси с метаном может перейти лишь 8 % гексана либо 0,4 % декана.
Из рис. IV.5 также следует, что критическое давление смеси повышается с увеличением ее молекулярной массы (или с увеличением температуры кипения второго компонента системы).
При одинаковой молекулярной массе температуры кипения изомерных парафиновых углеводородов более низкие, чем нормальных, и поэтому изомеры растворяются в метане в больших количествах, чем нормальные. Это относится также и к процессам обратного испарения — при одинаковых условиях изомерные углеводороды должны переходить в газовое состояние в большем количестве, чем нормальные углеводороды с той же молекулярной массой.
 На рис. IV.6 приведены изотермы бинарных смесей метана с н-гексаном, циклогексаном и бензолом. Все эти углеводороды имеют одинаковое число атомов углерода в молекуле и во всех этих системах менее летучий компонент имеет одинаковую температуру кипения. Критическое же давление бензола значительно отличается от критического давления других тяжелых компонентов.
На рис. IV.6 приведены изотермы бинарных смесей метана с н-гексаном, циклогексаном и бензолом. Все эти углеводороды имеют одинаковое число атомов углерода в молекуле и во всех этих системах менее летучий компонент имеет одинаковую температуру кипения. Критическое же давление бензола значительно отличается от критического давления других тяжелых компонентов.
Рис. IV.6. Изотермы фазового равновесия метана с углеводородами различных групп (углеводо-роды с одинаковым числом атомов в молекуле) (по А. С. Великовскому и Я. Д. Саввиной). 1— метан — н-гексан; 2 — метан — цикло-гексан; 3 — метан — бензол
Из рис. IV.6 следует, что в системах с нафтеновым углеводородом изотермы с одинаковой температурой находятся в области более высоких давлений, чем в системе с парафиновым углеводородом. Изотерма системы с ароматическим углеводородом лежит в области еще более высоких давлений. Следовательно, при одинаковых давлениях и температурах парафиновые углеводороды растворяются в метане лучше нафтеновых и ароматических той же температуры кипения. И для перевода ароматических углеводородов в однофазное газовое состояние требуется значительно большее давление, чем для нафтеновых, и еще более значительное, чем для парафиновых углеводородов.
В смесях метана с более тяжелыми углеводородами, имеющими критические давления, близкие к критическому давлению смеси метан — бензол, растворимость бензола в метане больше растворимости парафиновых углеводородов. Это же можно сказать о смесях толуола с метаном и парафиновыми углеводородами — т. е. при одинаковых критических давлениях ароматический углеводород растворяется в метане лучше, чем парафиновый.
Приведенные выше изотермы позволяют судить также и о растворимости метана в различных углеводородах.
Как уже было упомянуто, растворимость метана характеризуется расположением левой ветви изотерм, начинающейся на диаграмме давление — состав от точки, соответствующей упругости пара чистого менее летучего компонента (нулевое содержание метана) и продолжающейся до критической точки.
Из рис. IV.5 и IV.6 следует, что с уменьшением молекулярной массы углеводородов нормального строения растворимость метана в них при одинаковых условиях повышается (за исключением области давлений, близких к упругости паров индивидуальных компонентов). С приближением к критической области для всех углеводородов характерно более резкое повышение растворимости метана.
Изомерные парафиновые углеводороды растворяют метан хуже, чем углеводороды нормального строения. Это объясняется тем, что нормальные углеводороды по строению молекул отличаются от метана меньше, чем изомерные (на растворимость метана в парафиновых углеводородах влияет сходство в строении).
Растворимость метана в парафиновых углеводородах выше, чем в ароматических.
Приведенные изотермы бинарных систем позволяют также проследить за влиянием давления и температуры на растворимость в метане углеводородов, образующих конденсат.
Как уже упоминалось, для каждой углеводородной бинарной смеси свойственно увеличение растворимости жидких углеводородов в газе с повышением давления и температуры. При этом с ростом давления увеличивается переход в газовую фазу все более тяжелых углеводородов (см. рис. IV.5). Более слабо на переход углеводородов в газовое состояние в присутствии метана влияет повышение температуры (если давление значительно отличается от критического). Рост температуры при постоянном давлении приближает систему к критической области, где растворимость углеводородов в метане значительно увеличивается. При контакте метана с тяжелыми углеводородами (нефтью) с увеличением давления в системе заметно утяжеляется состав углеводородов, растворяющихся в метане. Повышение температуры слабо влияет на этот процесс. Общее же количество жидких углеводородов, перешедших из нефти в газовое состояние, растет с повышением как давления, так и температуры.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2276; Нарушение авторских прав?; Мы поможем в написании вашей работы!