
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач. Приклад 60При 25°С тиск насиченої пари води становить 3,166 кПа (23,75 мм рт
|
|
|
|
Приклад 60 При 25°С тиск насиченої пари води становить 3,166 кПа (23,75 мм рт. ст.). Визначите при тій же температурі тиск насиченої пари над 5 % водяним розчином карбаміду CO(NH2)2.
Рішення
Для розрахунку по формулі
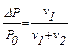 , звідси
, звідси 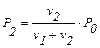
потрібно обчислити мольну частку розчинника. В 100 г розчину міститься 5 г карбаміду (мольна маса 60 г/моль) і 95 г води (мольна маса 18 г/моль). Кількість карбаміду та води відповідно дорівнює:
ν1 = 5/60 = 0,083 моль; ν2 = 95/18 = 5,278 моль.
Знаходимо мольну частку води:
x2 = ν2/(ν1 + ν2) = 5,278/(5,278 + 0,083) = 5,278/5,361 = 0,985.
Отже:
P2 = 0,985 ∙ 3,166 = 3,119 кПа (або 23,31 мм рт. ст.).
Приклад 61. Розрахуйте, при якій температурі повинен кристалізуватися розчин, що містить в 250 г води 54 г глюкози C6H12O6.
Рішення
М (С6Н12О6) = 180 г/моль.
Визначимо моляльність розчину:
Сm = 54 ∙ 1000/(180 ∙ 250) = 1,2 моль /1000 г води.
По формулі знаходимо:
Δtкр =КK ∙Cm,= 1,86 ∙ 1,2 = 2,23°С;
t′ кр = tкр – Δtкр = 0 – 2,23 = – 2,23°С.
Отже, розчин буде кристалізуватися при мінус 2,23 °С.
Приклад 62. Розчин, що містить 8 г деякої речовини в 100 г діетилового естера, кипить при 36,86°С, тоді як чистий ефір кипить при 35,6°С. Визначите молекулярну масу розчиненої речовини.
Рішення
З умови завдання знаходимо:
Δtкип = t′ кип – tкип = 36,86 – 35,6 = 1,26°С.
По рівнянню Δtкип = КЕ ∙Cm визначаємо моляльність розчину:
1,26 = 2,02 ∙Сm; звідки Сm = 1,26/2,02 = 0,624 моля на 1000 г естеру.
Мольну масу речовини знайдемо із співвідношення:
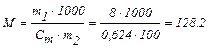 г/моль,
г/моль,
Молекулярна маса розчиненої речовини дорівнює 128,2 а.е.м.
Приклад 63. Визначити молекулярну масу неелектроліту, якщо його наважка масою 17,64 г була розчинена у воді й об'єм розчину довели до 1000 см3. Виміряний осмотичний тиск розчину склав 2,38 ∙ 105 Па при 20°С.
Рішення
Підставляючи експериментальні дані в рівняння Вант-Гоффа
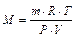
одержимо:
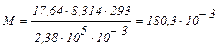 кг/моль або М = 180,3 г/моль.
кг/моль або М = 180,3 г/моль.
Молекулярна маса дорівнює 180,3 а.е.м.
Приклад 64. Наважка речовини масою 12,42 г розчинена в 500 см3 води. Тиск пари отриманого розчину при 20°С дорівнює 3732,7 Па. Тиск пари води при тій же температурі дорівнює 3742 Па. Розрахуйте мольну масу розчиненої речовини.
Рішення
Користуючись законом Рауля й з огляду на умови завдання, одержимо:
ΔР = 3742 – 3732,7 = 9,3 Па;
ν2 = 500/18 = 27,78 моль.
тоді число моль (ν1) розчиненої речовини дорівнює:
 моль.
моль.
Оскільки ν = m / M, відповідно
M1 = m / ν1 = 12,42/0,068 = 183 г/моль.
Приклад 65. Чому дорівнює при 0°С осмотичний тиск розчинів неелектролітів молярних концентрацій: 0,100; 0,800; 0,025 моль/дм3?
Рішення
Тому що всі розчини неелектролітів молярної концентрації 1 моль/дм3 мають однаковий осмотичний тиск, який дорівнює 22,7 ∙ 105 Па при 0°С. Тоді осмотичний тиск розчинів неелектролітів заданих концентрацій дорівнює 2,27 ∙ 105; 1,82 ∙ 106; 2,67 ∙ 104 Па відповідно.
Приклад 66. Розчин, що містить 0,85 г цинк хлорид в 125 г води, кристалізується при –0,23°С. Визначите ступінь дисоціації ZnCl2.
Рішення
Знайдемо моляльную концентрацію (Сm) солі в розчині.
Оскільки мольна маса ZnCl2 дорівнює 136,3 г/моль, відповідно
Сm = 0,85 ∙ 1000/(136,3 ∙ 125) = 0,050 моль на 1000 г Н2О.
Тепер визначимо зниження температури кристалізації без обліку дисоціації електроліту (кріоскопична стала води дорівнює 1,86):
Δtкр теор=КK ∙Cm,= 1,86 ∙ 0,05 = 0,093°.
Порівнюючи знайдене значення з експериментально визначеним зниженням температури кристалізації, обчислюємо ізотонічний коефіцієнт i:
i = Δtкр експ / Δtкр теор = 0,23/0,093 = 2,47.
Ступінь дисоціації солі знайдемо із співвідношення
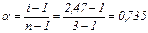
де n – число іонів, що утворюються при дисоціації молекул електроліту
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1300; Нарушение авторских прав?; Мы поможем в написании вашей работы!