
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач. Приклад 43. За 293 К в 2 кг води максимально розчиняється 1,51 кг кальція хлориду
|
|
|
|
Приклад 43. За 293 К в 2 кг води максимально розчиняється 1,51 кг кальція хлориду. Визначити розчинність.
Рішення.
Відповідно з формулою:
 .
.
Розчинність розраховуємо 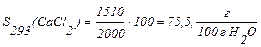
Розчинність СаС12 у воді при 293 К складає 75,5 г/(100г Н2О).
Приклад 44. Визначити розчинність і масову частку (%) розчиненої речовини в розчині, якщо 7,28 г її міститься у 42,34 г насиченого розчину.
Рішення.
Для визначення розчинності потрібно знайти кількість грамів речовини, розчиненої у 100 г розчинника.
Маса розчинника дорівнює: 42,34 – 7,28 = 35,06 г.
Складаємо пропорцію:
у 35,06 г розчинника міститься ─ 7,28 г речовини,
а у 100,00 г розчинника міститься ─ х речовини.
Звідси х = 100∙7,28 / 35,06 = 20,8 г, тобто у 100 г розчинника при даних умовах може розчинитися 20,8 г речовини.
Масова частка розчиненої речовини визначається за формулою:
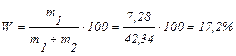 .
.
Приклад 45. Скільки грамів 5%-го розчину КС1 можна приготувати із 75г КС1?
Рішення.
а) У 100 г 5%-го розчину міститься 5 г КС1, а у х г 5%-го розчину міститься 75 г КС1.
х = 75∙100 / 5 = 1500 г розчину.
б) Відповідно до визначення масова частка розчиненої речовини запишемо рівняння з однією невідомою (mрозчину):
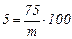 , звідси
, звідси 
Приклад 46. У 175 г води розчинено 25 г мідного купоросу СuSО4·5Н2О. Яка масова частка (%) купрум (ІІ) сульфату у цьому розчині?
Рішення.
Якщо розчинена речовина не містить у своєму складі кристалізаційної води, то при розрахунках, пов'язаних з визначенням масової частки, її формула до уваги не приймається. Але якщо розчинена речовина є кристалогідратом, в розрахунках потрібно врахувати кристалізаційну воду, тобто визначити, скільки безводного СuSО4 міститься у 25 г СuSО4 ∙5Н2О:
Розрахуємо мольну масу кристалогідрата і безводної солі:
М(СuSО4 ∙ 5Н2О) = 64 + 32 + 4∙16+ 5∙(2∙1+16) = 250 г/моль;
М(СuSО4) = 64 + 32 + 4∙16 = 160 г/моль.
Так як у 1 моль мідного купоросу міститься 1 моль купрум (ІІ) сульфату. Знайдемо скільки міститься СuSО4 у 25 г кристалогідрату:
у 250 г СuSО4 ∙ 5Н2О міститься ─ 160 г СuSО4,
а у 25 г СuSО4 ∙ 5Н2О міститься ─ х г СuSО4
знаходимо, що х = 25 ∙160 / 250 = 16 г.
Маса кристалічної води сировини складає:
25 – 16 = 9 г.
Загальна маса розчину складається з маси СuSО4 та Н2О дорівнює
16 + (9 + 175) = 200 г.
Масова частка розчиненої речовини визначається за формулою:
 .
.
Приклад 47. До 400 см3 20% розчину сульфатної кислоти з густиною 1,14 г/см3 додали 200 см3 води. Яка масова частка розчину, що утворився?
Рішення.
Знаходимо масу вихідного розчину:
m = ρ ∙ V;
m = 1,14∙400 = 456 г.
Розраховуємо кількість Н2SО4 в цьому розчині:
 , звідси
, звідси
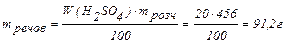
Маса розчину, що утворився після додавання води, дорівнює:
456 + 200 = 656 г.
Розраховуємо масову частку Н2SО4:
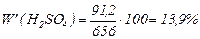
Отже, утворився розчин з масовою часткою 13,9 % Н2SО4.
Приклад 48. В наявності є два розчини глюкози: 45%-вий і 18%-вий. Потрібно приготувати 540 г 30%-вого розчину.
Рішення.
Складаємо схему для розрахунку вагових частин (ч) кожного з розчинів відповідно до правила «Хреста», які потрібно змішати:
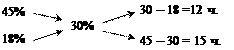
Загальна кількість масових частин розчину що готується складає
12 ч. + 15 ч. = 27 ч.
Отже, 45%-вий розчин потрібно змішати з 18%-вим у співвідношенні відповідно 12/15 вагових частин.
Далі розраховуємо яку масу складає одна вагова частина, знаючи що розчин який потрібно приготувати повинен мати масу 540 г й складатися з 27 ч. Звідси х = 540 / 27 = 20 г.
В результаті, 45%-вого розчину потрібно взяти 12 частин або 240г, а 18%-вого – 15 частин або 300 г.
Якщо необхідно приготувати новий розчин шляхом розведення більш концентрованого розчину водою, розрахунок виконується аналогічно, приймаючи воду за розчин 0%-вої концентрації.
Приклад 49. Приготувати 200 г 15%-вого розчину лугу виходячи із 40%-вого розчину.
Рішення.
Розрахунок виконується як і у попередньому прикладі:
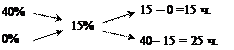
Увесь розчин вагою 200 г складає 40 ч.
Отже, щоб приготувати 200 г 15%-вого розчину лугу виходячи із 40%-вого розчину потрібно взяти 15 частин або 75 г 40%-вого розчину, а води – 25 частин, або 125 г.
При необхідності збільшення концентрації розчину шляхом змішування його з твердою речовиною, останню прирівнюють до розчину з концентрацією 100%. Розрахунки не відрізняються від наведених вище.
Приклад 50. Із 20%-вого розчину лугу необхідно приготувати 500 г 50% -вого розчину додавання сухого лугу.
Рішення.
Складаємо схему для розрахунку вагових частин 20%-вого розчину і сухої речовини, які потрібно змішати.

Увесь розчин вагою 500 г складає 80 ч.
Отже, для виконання завдання потрібно взяти 500∙50/80 = 312,5 г 20%-вого розчину, а сухого лугу – 500∙30/80 = 187,5 г.
Приклад 51. Розрахувати молярність розчину, якщо відомо, що 9,8 г сульфатної кислоти, розчинено 100 см3 розчину.
Рішення.
Розрахуємо мольну масу Н2SО4:
М(Н2SО4) = 2·1 + 32 + 4·16 = 98 г/моль.
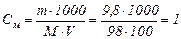 моль/ дм3 (М)
моль/ дм3 (М)
Отже, концентрація сульфатної кислоти – 1 моль/л.
Приклад 52. Скільки грамів калій нітрату потрібно для приготування 200 см3 2М розчину?
Рішення.
Розрахуємо мольну масу КNO3:
М(КNO3) = 39 + 14 + 3·16 = 101 г/моль.
Розраховуємо скільки грамів КNO3 знаходиться у 200 см3 2М розчину.
 , звідси
, звідси  г
г
Отже, для приготування 200 см3 2М розчину потрібно 40,4 г КNO3
Приклад 53. Скільки см3 22%-вого розчину НС1, густина якого 1,11 г/см3, потрібно для приготування 250см3 0,5М розчину?
Рішення.
Знаходимо, скільки грамів НС1 міститься у 250 см3 0,5М водного розчину:
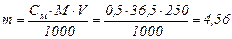 г
г
Визначаємо, в якій кількості 22%-вого розчину знаходиться 4,56 г НС1:
 , звідси
, звідси
 г
г
Переводимо масу розрахованої 22%-вої НС1 у об'єм:
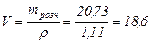 см3
см3
Таким чином, для приготування 250 см3 0,5М розчину необхідно взяти 18,6 см3 22%-вої НС1.
Приклад 54. 50 см3 0,3 М розчину солі розчинили водою до 80 см3. Яка молярна концентрація солі у розчині, що утворився?
Рішення.
Для вирішення такого типу завдань знання формул розчинених речовин не потрібне. При розведенні розчину кількість розчиненої речовини не змінюється, але концентрація розчину зменшується у стільки разів, у скільки разів збільшується об'єм розчину.
Спочатку визначимо скільки моль солі міститься у 50 см3 0,3 М розчину. Складаємо пропорцію:
0,3 моль міститься ─ у 1000 см3
х1 міститься ─ у 50 см3
х1 = 0,3∙50/1000 = 0,015 моль.
Тепер визначаємо, скільки моль солі міститься у 1 дм3 розчину після його розведення:
у 80 см3 міститься ─ 0,015 моль,
а у 1000 см3 міститься ─ х2.
Звідси х2 = 1000∙0,015 / 80 = 0,1875 моль.
Отже, концентрація солі у розведеному розчині – 0,1875 М.
Приклад 55. Визначити нормальність розчину сульфатної кислоти, в 250 см3 якого міститься 24,5 г Н2SО4.
Рішення.
Спосіб 1. Складаємо пропорцію, щоб визначити масу сульфатної кислоти об’ємом 1 дм3:
у 250 см3 розчину Н2SО4 міститься ─ 24,5 г кислоти
у 1000 см3 розчину Н2SО4 міститься ─ х г.
Звідси х = 1000 ∙24,5 / 250 = 98 г.
Еквівалент Н2SО4 дорівнює 1/2 молярної маси, тобто
Еm = М(Н2SО4)/n = 98/2 = 49 г/моль.
Отже даний розчин є (98/49 = 2) двонормальним.
Спосіб 2. Підставляємо значення об’єму, маси і молярної маси еквівалента сульфатної кислоти в формулу:
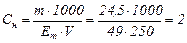 н.
н.
Приклад 56. У 2 дм3 розчину міститься 12,6 г НNО3. Обчислити нормальність даного розчину.
Рішення.
Визначаємо молярну масу еквівалента нітратної кислоти:
Еm = 63/1 = 63 г/моль.
Підставляємо значення об’єму, маси і молярної маси еквівалента сульфатної кислоти в формулу:
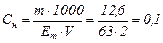 н.
н.
Приклад 57. Для нейтралізації 40 см3 розчину сульфатної кислоти було витрачено 24 см3 0,2 н розчину лугу. Визначити нормальність взятого розчину сульфатної кислоти.
Рішення.
Підставляємо значення об'ємів і концентрації лугу у формулу, що відображає закон еквівалентів:
Сн(NaOH)∙V(NaOH)=Сн(Н2SО4)V(Н2SО4).
Сн(Н2SО4) = Сн(NaOH)∙V(NaOH)/V(Н2SО4)= 0,2·24/40 = 0,12 н.
Таким чином, розчин сульфатної кислоти був 0,12 н.
Приклад 58. Обчислити моляльність розчину, що містить 10 г натрій гідроксиду в 1 дм3 води.
Рішення.
Густина води дорівнює 1 г/см3, тому маса розчинника дорівнює 1кг.
Розрахуємо мольну масу NаOН:
М(NаOН) = 23 + 16 + 1 = 40 г/моль.
Підставляємо значення маси розчиненої речовини, маси розчинника і мольної маси натрій гідроксиду в формулу:
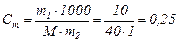 моль/кг,
моль/кг,
Приклад 59. Яка мольна частка йоду в розчині, що містить 20 г I2 в 500 г СС14?
Рішення.
Мольна маса йоду в розчині дорівнює 126,9 г/моль, а чотирихлористого вуглецю – 154,0 г/моль.
Визначаємо число моль кожного компоненту розчину:
розчиненої речовини: ν(І2) = 20/126,9 = 0,158 моль;
розчинника: ν(СС14) = 500/154,0 = 3,25 моль.
Знаходимо мольну частку йоду:
х(І2) = 0,158/(0,158+3,25) =0,046.
Мольна частка розчинника
х(СС14) = 1– х(І2) = 1 – 0,046 = 0,954
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1435; Нарушение авторских прав?; Мы поможем в написании вашей работы!