
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач. Приклад 39. Знайдіть константу рівноваги реакції 2А + В ⇄ 2D, яка знаходиться у газовій фазі в закритій посудині
|
|
|
|
Приклад 39. Знайдіть константу рівноваги реакції 2А + В ⇄ 2D, яка знаходиться у газовій фазі в закритій посудині, якщо вихідні концентрації А и В рівні відповідно 0,6 моль/л і 0,4 моль/л, а до моменту настання рівноваги прореагувало 25 % речовини В. Розрахуйте зміну
тиску в системі в порівнянні з первісним.
Рішення:
Запишемо вираження константи рівноваги для цієї реакції:
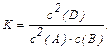
Визначимо рівноважні концентрації речовин.
До моменту настання рівноваги прореагувало 25 % речовини В, отже,
Δ с(В) = 0,25 · с0(В) = 0,25 · 0,4 = 0,1 моль/л.
Рівноважна концентрація речовини В дорівнює:
с(В) = с0(В) –Δ с(В) = 0,4 – 0,1 = 0,3 моль/л.
Відповідно до рівняння реакції,
Δ с (А) = 2 Δ с (В) = 2 · 0,1 = 0,2 моль/л.
Отже, рівноважна концентрація речовини А дорівнює:
с(А) = с0(А) – Δс(А) = 0,6 – 0,2 = 0,4 моль/л.
Відповідно до рівняння реакції, кількість речовини D, що утворилася, чисельно дорівнює кількості речовини А, що прореагувала, тому Δс(D) = 0,2 моль/л. Оскільки в первісний момент речовина D була відсутня, то рівноважна концентрація D дорівнює
с(D) = 0 + Δс(D) = 0 + 0,2 = 0,2 (моль/л).
Підставивши знайдені рівноважні концентрації речовин А, В та D у вираження для константи рівноваги, одержимо
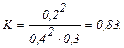
Зміна тиску в системі пропорційно зміні сумарної концентрації газоподібних речовин. Таким чином,
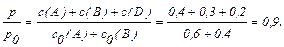
Тиск у системі в момент рівноваги буде становити 90 % від вихідного.
Приклад 40. У системі А(г) + В(г) ⇄ 2D(г) рівноважні концентрації дорівнюють: с(А) = 0,4 моль/л; с(В) = 0,9 моль/л; с(D) = 0,6 моль/л. Знайдіть константу рівноваги реакції, вихідних концентрацій А і В (речовина D у вихідній суміші відсутня).
Рішення:
Константа рівноваги для даної реакції дорівнює:
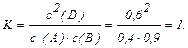
Відповідно до рівняння реакції, на утворення 2 моль D необхідно по 1 моль речовин А и В. Таким чином у результаті реакції утворилося 0,6 моль/л речовини D, отже на його утворення витратилося по 0,3 моль/л речовини А і речовини В. У такий спосіб вихідна концентрація речовини А дорівнює: свих.(А) = 0,4 + 0,3 = 0,7 моль/л, а вихідна концентрація речовини В дорівнює: свих.(В) = 0,9 + 0,3 = 1,2 моль/л.
Приклад 41. Як зміниться хімічна рівновага в системі
СаСО3(к) ⇄ СаО(к) + СО2(г); ΔН = 178,4 кДж/моль;
а) при введенні в систему вуглекислого газу; б) при введенні в систему кальцій оксиду; в) при збільшенні тиску; г) при збільшенні температури?
Рішення:
Відповідно до принципу Ле-Шателье, рівновага в системі зрушується таким чином, щоб зменшити зовнішній вплив.
а) Введення вуглекислого газу приводить до підвищення концентрації СО2. Для ослаблення цього впливу рівновага в системі повинна зміститися ліворуч.
б) Введення твердого кальцій оксиду не змінює концентрацію СаО у фазі СаО(к). Хімічна система знаходиться у рівновазі.
в) Збільшення тиску приводить до збільшення концентрації СО2(г) і практично ніяк не впливає на концентрації твердих компонентів. Рівновага зміщується ліворуч.
г) Збільшення температури може бути компенсовано ендотермічним процесом. Оскільки саме пряма реакція перебігає з поглинанням тепла, рівновага в системі зміщається праворуч.
Приклад 42. У якому напрямку зміститься рівновага в системах:
а) CO(г) + Cl2(г) ⇄ СOCl2(г); б) H2(г) + I2(г) ⇄ 2HI(г),
якщо при незмінній температурі збільшити тиск шляхом зменшення об'єму газової суміші?
Рішення:
а) перебіг реакції в прямому напрямку приводить до зменшення загального числа молей газів, тобто до зменшення тиску в системі. Тому, відповідно до принципу Ле-Шателье, підвищення тиску викликає зсув рівноваги убік прямої реакції.
б) перебіг реакції не супроводжується зміною числа моль газів і не проводить, отже, до зміни тиску. У цьому випадку зміна тиску не викликає зсуву рівноваги.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 951; Нарушение авторских прав?; Мы поможем в написании вашей работы!