
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна кінетика
|
|
|
|
Завдання для індивідуальної самостійної роботи
На основі стандартних ентальпій ΔH0298 і абсолютних ентропій S0298 речовин (додаток А. п.6) визначити:
Ø ΔH0298, ΔS0298 та ΔG0298 реакції. Зробити висновок щодо термодинамічної ймовірності перебігу реакції за стандартних умов, температуру при якій константа рівноваги дорівнюватиме 1 (ΔG0298 =0). Впливом температури на ΔH0298 і S0298 реакції знехтувати;
Ø область температур, в якій перебіг даній реакції термодинамічно імовірно. Розрахунки провести за рівняннями реакцій, наведених у таблиці.
| Варі-ант | Рівняння реакції | Варі-ант | Рівняння реакції |
| CO(г) + H2O(р) = CO2(г) + H2(г) | 4NH3 + 3O2 = 6H2O + 2N2 | ||
| Fe3O4 + CO = 3FeO + CO2 | CS2 + 3O2 = CO2 + 2SO2 | ||
| 2C2H2 + 5O2 = 4CO2 + 2H2O | Fe2O3 + 3CO = 2Fe + 3CO2 | ||
| H2 + CO2 = CO + H2O | 2H2S + SO2 = 3S + 2H2O | ||
| CO + 3H2 = CH4 + H2O | 2CH3OH + 3O2 = 2CO2 + 4H2O | ||
| C2H4 + 3O2 = 2CO2 + 2H2O | PbS + PbSO4 = 2Pb + 2SO2 | ||
| 4NH3 + 5O2 = 4NO + 6H2O | 2C2H6 + 7O2 = 4CO2 + 6H2O | ||
| NH3 + HCl = NH4Cl | CH4 + 2O2 = CO2 + 2H2O | ||
| 2H2O2 = 2H2O + O2 | 4HCl + O2 = 2H2O + 2Cl2 | ||
| 2SO2 + O2 = 2SO3 | 2PH3 + 4O2 = P2O5 + 3H2O | ||
| SO2 + NO2 = SO3 + NO | CH4 + 2Н2О= CO2 + 4H2 | ||
| CH4 + 4Cl2 = CCl4 + 4HCl | CH4 + Н2О= CO + 3H2 | ||
| SO2 + 2H2S = 3S + 2H2O | 2NH3 = 3H2 + N2 | ||
| 2H2S + 3O2 = 2H2O + 2SO2 | СН3ОН = 2H2 + СО | ||
| CaO + 3C = CaC2 + CO | С + O2 = CO2 |
Розділ хімії, що вивчає швидкість реакцій і залежність її від різних факторів (хімічної природи реагуючих речовин, їх концентрації, температури, тиску, впливу каталізаторів) має назву хімічна кінетика. Вплив перелічених факторів на швидкість значною мірою залежить також від типу системи, в якій відбувається реакція.
Швидкість гомогенної реакції вимірюється кількістю речовини, що вступає в реакцію або утворюється внаслідок реакції за одиницю часу в одиниці об'єму системи. Швидкість гетерогенної реакції вимірюється кількістю речовини, що вступає в реакцію або утворюється внаслідок реакції за одиницю часу на одиниці поверхні розділу фаз.
Швидкість реакції (v) у інтервалі часу від t1 до t2 визначається співвідношенням:

Про вплив концентрації на швидкість реакції в гомогенних системах можна судити виходячи з закону діючих мас:
за сталої температури швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин які входять до рівняння хімічної реакції, у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам.
Для реакції в загальному вигляди:
aА + bВ + …. = mM + nN + …
швидкість можна виразити рівнянням:
v = k CаA ∙CвB = k [А]а ∙[В]в …,
де v – істинна швидкість гомогенної хімічної реакції в моль/(л∙с);
k – константа швидкості хімічної реакції (коефіцієнт пропорційності).
С – символ молярної концентрації (моль/л) в даний момент часу τ;
[ ] – символ молярної концентрації (моль/л) для оборотних процесів у стані рівноваги (рівноважні концентрації);
А, В, М, N – формульне позначення речовин;
а, b, m, n – стехіометричні коефіцієнти.
Константа швидкості хімічної реакції (k) відповідає швидкості такої реакції де концентрації реагуючих речовин дорівнюють 1 моль/л, або коли коефіцієнт пропорційності в кінетичному рівнянні дорівнює 1. (фізичний зміст константи). Виходить, що k не залежить від концентрації реагуючих речовин. Впливають на k природа реагуючих речовин (для кожної реакції своя константа швидкості) та температура.
Для гетерогенної системи в рівняння швидкості хімічної реакції концентрації твердих речовин не входять, оскільки вони практично не змінюються і як стала величина входять до складу константи скорості. На швидкість гетерогенної реакції буде впливати швидкість підведення реагуючих речовин і відведення продуктів реакції від поверхні розділу фаз.
Швидкість хімічної реакції зі зростанням температури на кожні десять градусів збільшується у 2-4 рази (емпіричне правило Вант-Гоффа). Математично це правило можна виразити співвідношенням:
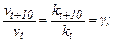
де vt, kt – швидкість і константа швидкості реакції при температурі t;
vt+10, kt+10 – швидкість і константа швидкості при збільшення температури на 10 °; 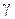 – температурний коефіцієнт швидкості реакції. Температурний коефіцієнт швидкості реакції – це число, що показує, у скільки разів зростає швидкість даної реакції підвищенні температури на 10 °. У загальному випадку
– температурний коефіцієнт швидкості реакції. Температурний коефіцієнт швидкості реакції – це число, що показує, у скільки разів зростає швидкість даної реакції підвищенні температури на 10 °. У загальному випадку

Температура впливає на швидкість реакції, збільшуючи константу швидкості реакцій.
Швидка зміна швидкості реакції зі зміною температури пояснює теорія активації (за цією теорією до хімічної взаємодії вступають тільки активні молекули, що володіють достатньою енергією для здійснення даної реакції). Неактивні частинки можна зробити активними, якщо надати їм додаткову енергію, - цей процес називається енергією активації. При підвищенні температури число активних частинок зростає, тому і збільшується швидкість хімічної реакції.
Енергія, яку треба надати молекулам (частинкам) реагуючих речовин, щоб перетворити їх в активні, називається енергією активації.
Константа швидкості реакції залежить від температури і енергії активації. Ця залежність представлена рівнянням Арреніуса:
 ,
,
де А – множник, що враховує зіткнення активних молекул при визначеній орієнтації; е – основа натурального логарифму, дорівнює 2,718; R – універсальна газова стала, що дорівнює 8,314 Дж/(моль·К); Еа – енергія активації Дж/моль
Якщо енергія активації невелика, то буде високою константа швидкості (k) і швидкість хімічної реакції.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!