
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач. Приклад 33. Для реакції 2NO(г) + O2(г) ⇄ 2NO2(г), що перебігає в газовій фазі, константа швидкості дорівнює 0,8
|
|
|
|
Приклад 33. Для реакції 2NO(г) + O2(г) ⇄ 2NO2(г), що перебігає в газовій фазі, константа швидкості дорівнює 0,8. Розрахуйте:
а) початкову швидкість реакції, якщо вихідні концентрації речовин дорівнюють: с(NO) = 0,4 моль/л, с(О2) = 0,3 моль/л;
б) швидкість цієї реакції в момент, коли прореагує 25 % NО.
Рішення:
а) Відповідно до закону діючих мас, швидкість даної реакції описується рівнянням:
v = k·с2(NО)·с(O2).
Отже, швидкість реакції в початковий момент часу:
v = 0,8·0,42·0,3 = 0,0384 моль/(л · с).
б) Швидкість цієї реакції в момент, коли прореагує 25 % NО описується рівнянням:
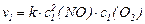 ,
,
де с1(NО) і с1(O2) – нові концентрації NО та О 2 (після того, як прореагувало 25 % NО).
Виходячи з рівняння реакції, розрахуємо величини с1(NО) і с1(O2). 25 % NО становить
Δ с(NО) = 0,4 ·0,25 = 0,1 моль/л, тоді
с1(NО) = с0(NО) – Δ с(NО) = 0,4 – 0,1 = 0,3 моль/л.
У відповідності зі стехіометричними коефіцієнтами рівняння реакції, зменшення концентрації О2 дорівнює
Δ с (О2) = Δ с(NО): 2 = 0,1:2 = 0,05 моль/л.
Таким чином, с1(О2) = с0(О2) – Δс(О2) = 0,3 – 0,05 = 0,25 моль/л.
Отже, v1 = 0,8 · 0,32 · 0,25 = 0,018 моль/(л · с).
Приклад 34. Як зміниться швидкість реакції 2NO(г) + Сl2(г) ⇄ 2NOCl(г), якщо: а) збільшити тиск у реакційній посудині у два рази; б) зменшити об'єм посудини в 4 рази?
Рішення:
а) Відповідно до закону діючих мас, швидкість даної реакції описується рівнянням:
v = k·с2(NО)·с(Cl2).
Оскільки збільшення тиску приводить до пропорційного збільшення концентрацій газоподібних речовин (p=cRT), концентрації реагентів у нових умовах будуть рівні:
с1(NО) = 2с0(NО), с1(С12) = 2с0(С12).
Константа швидкості реакції при збільшенні тиску не змінюється, і швидкість реакції в нових умовах буде дорівнює:
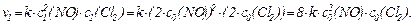
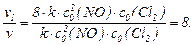
Швидкість реакції збільшиться у 8 разів.
б) Зменшення об'єму посудини в 4 рази приводить до відповідного збільшення концентрацій реагентів. Таким чином, с2(NО) = 4с0(NО), а с2(С12) = 4с0(С12). Вирішуючи завдання за аналогією з попереднім пунктом, одержимо v2/v = 64, тобто зменшення об'єму посудини в 4 рази приведе до збільшення швидкості у 64 рази.
Приклад 35. Температурний коефіцієнт швидкості хімічної реакції дорівнює 2,1. У скільки разів зросте швидкість реакції при збільшенні температури в реакційній посудині з 15 до 38°С?
Рішення:
Відповідно до правила Вант-Гоффа:
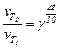 ;
; 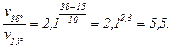
Швидкість реакції при збільшенні температури в реакційному об’ємі з 15 до 38°С зросте у 5,5 разів.
Приклад 36 Розчинення зразка цинку в хлоридній кислоті при 20 ° С закінчується через 27 хвилин, а при 40°С такий же зразок металу розчиняється за 3 хвилини. За який час даний зразок цинку розчиниться при 55°С?
Рішення:
Розчинення цинку в хлоридній кислоті описується рівнянням:
Zn + 2HCl = ZnCl2 + H2↑.
Оскільки у всіх трьох випадках розчиняється однакова кількість зразка, то можна вважати що середня швидкість реакції оберненопропорційна часу реакції. Отже при нагріванні від 20°С до 40°С швидкість реакції збільшується в 27/3 = 9 разів. Це означає, що коефіцієнт у рівнянні Вант-Гоффа
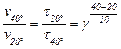
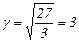
Значить при нагріванні до 55 °С швидкість реакції збільшується в
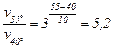 ,
,
а час реакції складе 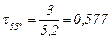 хв, або 34,6 с.
хв, або 34,6 с.
Приклад 37 На скільки градусів треба підвищити температуру реакції, щоб її швидкість збільшилася в 729 разів (γ = 3)?
Рішення:
Залежність швидкості хімічної реакції від температури визначається емпіричним правилом Вант-Гоффа з якого після логарифмування, виражаємо підвищення температури (Δt):
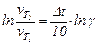 ,
,
звідки
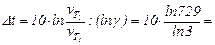 60°
60°
Щоб швидкість хімічної реакції збільшилася в 729 разів необхідно підвищити температуру системи на 60°.
Приклад 38 Енергія активації деякої реакції під час відсутності каталізатора дорівнює 32,3·103 Дж/моль, а в присутності каталізатора вона дорівнює 20,9·103 Дж/моль. У скільки разів зросте швидкість цієї реакції в присутності каталізатора при 25°С.
Рішення:
Енергію активації реакції без каталізатора позначимо Еа, а в присутності каталізатора Еа′. Відповідно константи швидкості цієї реакції рівні k і k′; відношення k′/k показує, у скільки разів швидкість реакції в присутності каталізатора більше швидкості цієї ж реакції без каталізатора. Використовуючи рівняння Арреніуса, запишемо
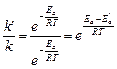
звідки
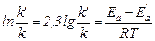
Підставивши відповідні значення величин з умови завдання, одержимо
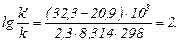
Таким чином, k'/k = 102 = 100, тобто при даній температурі реакція в 100 разів швидша в присутності каталізатора
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1769; Нарушение авторских прав?; Мы поможем в написании вашей работы!