
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання типових задач. Приклад 26. Користуючись даними про стандартні энтальпії утворення речовин у реакції 2Мg(к) + СО2 (г) = 2MgО(к) + С(графіт) обчислити
|
|
|
|
Приклад 26. Користуючись даними про стандартні энтальпії утворення речовин у реакції 2Мg(к) + СО2 (г) = 2MgО(к) + С(графіт) обчислити ΔΗ°298 (р-ції).
Рішення:
Виходячи з табличних значень энтальпій утворення СО2 і MgO і з огляду на те, що стандартні энтальпії утворення простих речовин дорівнюють нулю, знаходимо величину стандартної энтальпії реакції застосовуючи наслідок із закону Гесса:
ΔΗ°298 (р-ції) =2 ΔΗ°298 (MgO) – ΔΗ°298 (CO2) = 2·(– 601,8) – (– 393,5) =
= – 810,1 кДж/моль.
Приклад 27. Виходячи з теплоти утворення газоподібного діоксиду вуглецю (– 393,5 кДж/моль) і термохімічного рівняння С(графіт) + 2 N2О(г) = =2 N2(г) + CО2(г); ΔΗ°298 = – 557,5 кДж. Обчислити теплоту утворення N2О(г).
Рішення:
Записуємо математичне вираження для хімічної реакції застосовуючи наслідок із закона Гесса
ΔΗ°298 (р-ції) = (ΔΗ°298 (CO2) + 0) – (2· ΔΗ°298 (N2О) + 0),
звідки
2· ΔΗ°298 (N2О) = ΔΗ°298 (CO2) – ΔΗ°298 (р-ції) = –393,5 – (–557,5) = 164 кДж.
отже, ΔΗ°298 (N2О) = 164 / 2 = 82 кДж/моль.
Приклад 28. Виходячи з теплот реакцій окиснення As2O3 киснем і озоном:
As2O3 + O2 = As2O5; ΔΗ°298 (р-ції)1 = – 271 кДж;
3 As2O3 + 2 O3 = 3 As2O5; ΔΗ°298 (р-ції)2 = – 1096 кДж.
Обчислити теплоту утворення озону з молекулярного кисню.
Рішення:
Теплоту утворення озону з молекулярного кисню обчислюють із урахуванням наступного рівняння хімічної реакції:
3 O2 = 2 O3.
На підставі закону Гесса з термохімічними рівняннями можна оперувати так само, як і з алгебраїчними. Для одержання потрібного результату треба рівняння взаємодії кисню (1) помножити на 3 і відняти рівняння озонування (2).
3 As2O3 + 3 O2 – 3 As2O3 – 2 O3 = 3 As2O5 – 3 As2O5;
3 O2 – 2 O3 = 0; або 3 O2 = 2 O3.
отже,
ΔΗ°298 (р-ції) = 3· ΔΗ°298 (р-ції)1 – ΔΗ°298 (р-ції)2 = 3·(– 271) – (– 1096) = 283 кДж.
При утворені 1 моль озону з молекулярного кисню буде потрібно підвести
ΔΗ°298 (р-ції) = 283/3 = 94,3 кДж.
Приклад 29. У якому стані ентропія 1 моль речовини більше: у кристалічному або в пароподібному при тій же температурі?
Рішення:
Ентропія є міра невпорядкованості стану речовини. У кристалі частки (атоми, іони) розташовані впорядковано й можуть перебувати лише в певних точках простору, а для газу таких обмежень немає. Об'єм 1 моль газу набагато більше, ніж об'єм 1 моль кристалічної речовини; можливість хаотичного руху молекул газу більше. А тому що ентропію можна розглядати як кількісну міру хаотичності атомно-молекулярної структури речовини, то ентропія 1 моль пари речовини більше ентропії його кристалів при однаковій температурі.
Приклад 30. Скільки тепла виділиться при спалюванні 38 г сірковуглецю, якщо його теплота утворення ΔΗ°298 (СS2) = 62,7 кДж/моль. Визначити теплотворну здатність сірковуглецю у кДж/кг та кДж/м3.
Рішення:
Записуємо рівняння спалювання сірковуглецю:
СS2 + 3 O2 = СO2 + 2 SО2
Обчислюємо ΔΗ°298 (р-ції), застосовуючи наслідок із закону Гесса:
ΔΗ°298 (р-ції) = (ΔΗ°298 (CO2) + 2· ΔΗ°298 (SО2)) – (ΔΗ°298 (СS2) + 0)= – 393,5 +
+ 2·(– 296,9) – 62,7 = – 1050 кДж/моль,
Оскільки стандартні теплові ефекти відносять до утворення одного моль речовини, визначимо кількість СS2, що спалюється
М (СS2) = 12 + 2·32 = 76 г/моль.
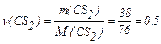 моль;
моль;
Кількість тепла, що виділиться при спалюванні сірковуглецю, складе:
Q = – ν(СS2) · ΔΗ°298 (р-ції) = – 0,5 · (– 1050) = 525 кДж.
Теплотворна здатність сірковуглецю:
Q’ = – ΔΗ°298 (р-ції)/(М (СS2)·10–3) = – 1050/(76·10–3)= – 13,82·103 кДж/кг;
Q’’ = – ΔΗ°298 (р-ції)/(Vm ·10–3) = – 1050/(22,4·10–3)= – 46,88·103 кДж/м3
Приклад 31. Скільки тепла (у кДж) виділиться при отриманні 40 г сульфур (IV) оксиду з простих речовин, якщо при згорянні 6,4 г сірки виділяється 59,3 кДж тепла.
Рішення:
Під час розв'язування всіх типів задач з використанням термодинамічних величин слід звертати увагу, в яких одиницях наведено табличні значення – кДж/моль; Дж/моль; ккал/моль; кал/моль і т.д За необхідності переведення цих величин з одних одиниць виміру в інші можна скористатись відношенням: 1 кал = 4,18Дж.
Реакція згоряння сірки відбувається за рівнянням:
S(к) + О2 (г) = SО2 (г) + ΔQ
За допомогою цього рівняння знаходимо масу сірки, необхідну для отримання 40 г SО2.
При згорянні 32 г сірки утворюється - 64 г SО2;
х(г) сірки - 40 г SО2, х(S) = 32∙4/64 = 20 г.
За масою сірки визначаємо кількість тепла, що виділиться при Ії згоранні.
При згорянні 6,4 г сірки виділяється - 59,3 кДж тепла;
20 г “ - “ - “ - “ - “ - ΔQ; звідки
ΔQ = 59,3∙20/6,4 = 185,3 кДж.
ΔН = – 185,3 кДж/моль.
Приклад 32. Виходячи зі значень стандартних теплот утворення й абсолютних стандартних энтропій відповідних речовин визначити ΔG°298 реакції, що перебігає відповідно до рівняння:
NH3(г) + НСl(г) = NH4Cl(кр).
Чи можлива ця реакція при стандартних умовах?
Рішення:
Енергія Гіббса (ΔG°298) є функцією стану й обчислюється зі співвідношення величини ΔН°298 і Δ S °298:
ΔΗ°298 (р-ції) = ΔΗ°298 (NH4Cl) – (ΔΗ°298 (НСl) + ΔΗ°298 (NH3)) = – 314,22 –
– (– 92,31 – 45,94) = – 175,97 кДж.
ΔS°298 (р-ції) = S°298 (NH4Cl) – (S°298 (НСl) + S°298 (NH3)) = 95,81 – (186,79 +
+ 192,66) = – 283,64 кДж/К.
ΔG°298 (р-ції) = ΔΗ°298 (р-ції) – Т· ΔS°298 = – 175,97·103 – 298·(–283,64) =
= – 91450 Дж.
Тому що ΔG°298 (р-ції) < 0, то реакція довільно перебігає при стандартних умовах.
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1198; Нарушение авторских прав?; Мы поможем в написании вашей работы!