
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчини
|
|
|
|
Завдання для індивідуальної самостійної роботи
7.1 Написати вираз константи рівноваги оборотної реакції, що наведена у таблиці Визначити, у який бік зміститься рівновага оборотної реакції при:
а) підвищенні температури (p = const); б) підвищенні тиску (T = const).
| Варі-ант | Рівняння реакції | ΔH0298, кДж |
| COCl2 ↔ CO + Cl2 | 112,5 | |
| CO2 + 2H2 ↔ CH3OH(г) | 193,3 | |
| 2N2O ↔ 2N2 + O2 | -163,1 | |
| 2NO + Cl2 ↔ 2NOCl | -73,6 | |
| 3O2 ↔ 2O3 | 184,6 | |
| CO + H2O(г) ↔ CO2 + H2 | -41,2 | |
| H2 + I2(г) ↔ 2HI | 51,9 | |
| N2 + O2 ↔ 2NO | 180,7 | |
| 2H2 + O2 ↔ 2H2O(г) | 483,7 | |
| 2CO + O2 ↔ 2CO2 | -566 | |
| N2O4 ↔ 2NO2 | ||
| 2NO + O2 ↔ 2NO2 | -113 | |
| 2SO3 ↔ 2SO2 + O2 | 196,6 | |
| N2 + 3H2 ↔ 2NH3 | -92,5 | |
| 2HBr ↔ H2 + Br2(г) | 72,5 | |
| 4HCl + O2 ↔ 2H2O + 2Cl2 | -114,5 | |
| N2 + 2O2 ↔ 2NO2 | 67,5 | |
| C + H2O(г) ↔ CO + H2 | ||
| 2NH3 ↔ N2 + 3H2 | 92,5 | |
| 2SO2 + O2 ↔ 2SO3 | -196,6 | |
| 2NOCl ↔ 2NO + Cl2 | 73,6 | |
| H2 + CO2 ↔ CO + H2O(г) | 41,2 | |
| CO + Cl2 ↔ COCl2 | -112,5 | |
| 2NO2 ↔ N2O4 | -58 | |
| 2H2S + 3O2 ↔ 2H2O +2SO2 | -561,1 | |
| CO + H2 ↔ C + H2O(г) | -131 | |
| CO + H2O(г) ↔ H2 + CO2 | -41,2 | |
| 2H2O +2SO2↔ 2H2S + 3O2 | 561,1 | |
| CH4 + H2O(г) ↔ CO + 3 H2 | 206,64 | |
| CH4 +0,5 О2 ↔ CH3OН(г) | -126,35 |
7.2 Як зміниться швидкість прямої та оборотної реакції, якщо об’єм газової суміші збільшити (зменшити) в n разів?
| Варіант | Рівняння реакції | n |
| 2SO2 + O2 ↔ 2SO3 | збільшити в 3 рази | |
| 2NO + O2 ↔ 2NO2 | збільшити в 3 рази | |
| N2 + 3H2 ↔ 2NH3 | зменшити в 3 рази | |
| 2NO + Cl2 ↔ 2NOCl | збільшити в 4 рази | |
| CO + H2O(г) ↔ CO2 + H2 | зменшити в 3 рази | |
| 2N2 + O2 ↔ 2N2O | збільшити в 3 рази | |
| 4NH3 + 5O2 ↔ 4NO + 6H2O | зменшити в 2 рази | |
| 4NH3 + 3O2 ↔ 2N2 + 6H2O | зменшити в 2 рази | |
| N2O4 ↔ 2NO2 | збільшити в 4 рази | |
| 4HCl + O2 ↔ 2H2O(г) + 2Cl2 | збільшити в 2 рази | |
| 2H2S + 3O2 ↔ 2H2O + 2SO2 | збільшити в 2 рази | |
| 3O2 ↔ 2O3 | збільшити в 3 рази | |
| CO + Cl2 ↔ COCl2 | збільшити в 4 рази | |
| 2 CO ↔ 2C + О2 | збільшити в 3 рази | |
| CO2 ↔C + О2 | збільшити в 10000 раз |
Як зміниться швидкість прямої та оборотної реакції, якщо тиск збільшити (зменшити) в n разів?
| Варіант | Рівняння реакції | n |
| 2NO2 ↔ 2NO + O2 | зменшити в 3 рази | |
| 2SO3 ↔ 2SO2 + O2 | зменшити в 2 рази | |
| 2NH3 ↔ N2 + 3H2 | збільшити в 3 рази | |
| 2NOCl ↔ 2NO + Cl2 | зменшити в 4 рази | |
| 2N2O ↔ 2N2 + O2 | збільшити в 3 рази | |
| 4NH3 + 4O2 ↔ 2N2O + 6H2O | зменшити в 2 рази | |
| 4NH3 + 3O2 ↔ 2N2 + 6H2O | зменшити в 2 рази | |
| 2H2S+3O2↔2H2O+2SO2 | зменшити в 2 рази | |
| 4HCl + O2 ↔ 2H2O(г) + 2Cl2 | збільшити в 2 рази | |
| CO + Cl2 ↔ COCl2 | зменшити в 4 рази | |
| 2O3 ↔ 3O2 | зменшити в 3 рази | |
| N2O4 ↔ 2NO2 | збільшити в 4 рази | |
| 2C + О2 ↔ 2 CO | зменшити в 4 рази | |
| C + О2 ↔ CO2 | зменшити в 3 рази | |
| CН4 ↔ C + 2 Н2 | збільшити в 4 рази |
7.3 Обчислити константу рівноваги оборотної реакції, вихідні та рівноважні концентрації компонентів у системах (величини, які треба обчислити, позначені у таблиці x).
| Варіант | Рівняння реакції | Kp | Рівноважні концентрації, моль/л | Вихідні концентрації, моль/л |
| 2SO2 + O2 ↔ 2SO3 | x | [SO2] = 0,04, [O2] = 0,06, [SO3] = 0,02 | [SO2] = x 1 [O2] = x 2 | |
| N2 + 3H2 ↔ 2NH3 | x | [N2] = 0,03, [H2] = 0,1, [NH3] = 0,4 | [N2] = x 1 [H2] = x 2 | |
| 2CO + O2 ↔ 2CO2 | x | [CO] = 4, [O2] =1, [CO2] = 2 | [CO] = x 1 [O2] = x 2 | |
| H2 + I2 ↔ 2HI | x | [H2] = x 1, [I2] = x 2, [HI] = 0,04 | [H2] = 0,03 [I2] = 0,03 | |
| CO + H2O ↔ CO2 + H2 | x | [CO] = x 1, [H2O] = x 2, [CO2] = 0,01, [H2] = x 3 | [CO] = 0,03 [H2O] = 0,03 | |
| 2N2 + O2 ↔ 2N2O | x | [N2] = 0,72, [O2] = 1,12, [N2O] = 0,84 | [N2] = x 1 [O2] = x 2 | |
| N2 + 3H2 ↔ 2NH3 | x | [N2] = 3, [H2] = 9, [NH3] = 4 | [N2] = x 1 [H2] = x 2 | |
| CO + Cl2 ↔ COCl2 | 39,4 | [CO] = 0,2, [COCl2] = 0,8 | [Cl2] = x | |
| H2 + I2 ↔ 2HI | x | [HI] = 0,08, [I2] = 0,025, [H2] = 0,04 | [H2] = x 1 [I2] = x 2 | |
| 2NO + O2 ↔ 2NO2 | x | [NO] = 0,02, [O2] = 0,3, [NO2] = 0,06 | [NO] = x 1 [O2] = x 2 | |
| CO + H2O ↔ CO2 + H2 | [CO] = x 1, [CO2] = x 2, [H2O] = x 3, [H2] = x 4 | [CO] = [H2O] = 0,02 | ||
| 4HCl + O2 ↔ 2H2O + 2Cl2 | x | [H2O] = [Cl2] = 0,14, [HCl] = 0,2, [O2] = 0,32 | [HCl] = x 1 [O2] = x 2 | |
| H2 + I2 ↔ 2HI | [HI] = x | [H2] = 2 [I2] = 1 | ||
| CO + H2O ↔ CO2 + H2 | [CO] = x 1, [CO2] = x 2, [H2O] = x 3, [H2] = x 4 | [CO] = 0,01 [H2O] = 0,03 | ||
| CO + Cl2 ↔ COCl2 | x | [COCl2] = 0,45 | [CO] =2 [Cl2] = 2 | |
| H2 + I2 ↔ 2HI | [HI] = 0,0315, [H2] = x, [I2] = 0,0114 | [H2] = x, [I2] = x | ||
| PCl5 ↔ PCl3 + Cl2 | 0,041 | [Cl2] = 0,1 | [PCl5] = x | |
| 2HI ↔ H2 + I2 | 0,02 | [H2] = x | [HI] = 0,05 | |
| CO + H2O ↔ CO2 +H2 | [CO] = x 1, [CO2] = 2, [H2O] = x 3, [H2] = x 4 | [CO] = 1 [H2O] = 3 |
Продовження табл.
| 2NO2 ↔ N2O4 | 7,15 | [NO2] = x | [N2O4] = 3 | |
| CH2O ↔ H2 + CO | x | [H2] = 0,2 | [CH2O] = 1 | |
| CO + H2O ↔ CO2 + H2 | [H2] = x | [CO] = 2 [H2O] = 2 | ||
| SO2 + NO2 ↔ SO3 + NO | x | [SO2] = 0,6, [NO2] = 0,2 | [SO3] = x 1 [NO] = x 2 | |
| H2 + I2 ↔ 2HI | x | [HI] = 0,6, [H2] = 0,1, [I2] = 0,2 | [H2] = x 1 [I2] = x 2 | |
| CO + H2O ↔ CO2 + H2 | x | [CO2] = 0,05, [CO] = x1, [H2] = x3; [H2O] = x2 | [CO] = 0,08 [H2O] = 0,06 | |
| 2C + O2 ↔ 2CO | х | [O2] = 1, [CO2] = 2 | C = 1 [O2] = x 1 | |
| C + O2 ↔ CO2 | C = х, [O2] = x1, [CO2] = x2 | [CO2] = 1 [O2] =2, C= 1 | ||
| 2FeS + 3,5 O2 ↔ Fe2O3 + 2SO2 | x | [O2] =0,5, [SO2] = x1 | [O2] = 1 [SO2] =2 | |
| H2O+ Cl2 ↔ HCl + HClO | x | [O2] = x1, [Cl2] = 1 [H2O] = x3 [HCl] = x2 | [O2] = 1 [HCl] =2 | |
| CO + 2 H2↔ CH3OH | x | [CH3OH] = x1 [H2] = x2 | [CO] = 1, [H2] =5 |
Розчином називається гомогенна термодинамічно стійка система, що складається з двох або більшої кількості незалежних компонентів, співвідношення між якими можуть змінюватися у широких межах. Розчини бувають газоподібні, рідкі і тверді. Прикладом газоподібного розчину може бути повітря, рідкого – розчин глюкози у воді і твердого – різноманітні сплави металів.
Кожний розчин складається із розчинника і розчиненої речовини. Розчинником вважають той компонент, який у чистому вигляді існує в такому ж агрегатному стані, як і розчин. У випадку, коли розчинник і розчинена речовина не відрізняються за агрегатним станом від розчину, розчинником вважається той компонент, який знаходиться у більшій кількості. У розчинах електролітів незалежно від співвідношення компонентів і їхнього агрегатного стану електроліти завжди розглядаються як розчинені речовини.
Розчинність – це властивість одних речовин взаємодіяти з іншими і рівномірно розподілятися в них під дією теплового руху частинок та дифузії. Для визначення розчинності твердих тіл беруть 100 г розчинника і розчиняють речовину за даної температури та інтенсивному розмішуванні до насичення. Межа розчинності фіксується наявністю стабільної твердої фази. Розчинність газів визначається максимальним числом об'ємів газоподібної речовини в одному об'ємі розчинника за даних температури і тиску.
Властивості розчину визначаються якісним й кількісним складом системи. На практиці кількісний характер розчинів виражають за допомогою наступних величин: а) безрозмірних – масова, об'ємна й молярна частки; б) розмірних – масова концентрація речовини, молярна концентрація речовини, молярна концентрація еквівалента речовини й моляльністъ та ін.
Концентрацією розчину називається кількість розчиненої речовини, що міститься у певній кількості розчину або розчинника.
Масова частка (процентна концентрація) – відношення маси розчиненої речовини до маси розчину, або кількість грамів розчиненої речовини, що міститься у 100 г розчину:
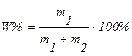
де m1 – маса розчиненої речовини, г; m2 – маса розчинника, г.
Молярна концентрація (молярність – См) відображається числом моль розчиненої речовини в одному кубічному дециметрі (моль/дм3).
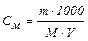 ,
,
де М – молярна маса розчиненої речовини V – об’їм розчину в см3; m – маса розчиненої речовини, г.
Еквівалентна концентрація (нормальність) – визначається числом еквівалентів речовини, що міститься в 1 дм3 розчину.
Нормальність позначається символом Сн, або "N". Розмірність показника моль/дм3 або "н".
В загальному вигляді можна записати:
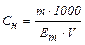
де Em – молярна маса еквівалента розчиненої речовини.
Знаючи нормальність і об'єм однієї речовини, а також об'єм другої речовини, що вступає в реакцію з першою, можна обчислити нормальність другої:
Сн1∙V1=Сн2V2.
Моляльна концентрація (моляльність) визначається кількістю моль розчиненої речовини у 1000 г розчинника.
В загальному вигляді можна записати так:
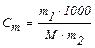
де m1 – маса розчиненої речовини; m2 – маса розчинника.
Мольна частка – відношення числа молів даної речовини до суми молів усіх речовин, що містяться в розчині.
Для бінарного розчину:
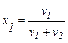 ;
; 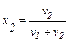
де х1 ,ν1 і х2 ,ν2 – відповідно мольні частки та число моль розчинника і розчиненої речовини.
Для двохкомпонентного розчину х1 + х2 = 1, а для багатокомпонентних розчинів ∑х = 1.
Титр розчину – це виражена в грамах маса розчиненої речовини, що міститься в 1 см3 (1 мл) розчину. Титр Т(Х) обчислюють як відношення маси розчиненої речовини m(X) до об’єму розчину (розмірність г/см3, або г/мл):
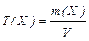
Титр за речовиною, що визначається, Т(Y/Х) – це виражена в грамах маса речовини Х, що еквівалентна 1 мл титранту Y (розмірність г/см3, або г/мл):
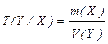
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 519; Нарушение авторских прав?; Мы поможем в написании вашей работы!