
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы кристаллических твердых тел
|
|
|
|
Существует два признака для классификации кристаллов: 1) кристаллографический; 2) физический (природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними).
1. Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
Кристаллическая решетка может обладать различными видами симметрии. Сим метрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853—1919), присущи 230 комбинаций элементов сим метрии, или 230 различных пространственных групп.
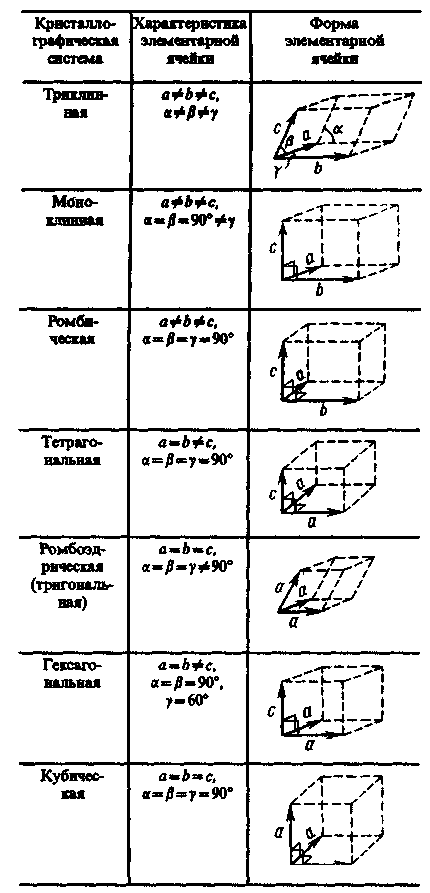
С переносной симметрией в трехмерном пространстве связывают понятие трехмерной периодической структуры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристаллографом О. Бравэ (1811—1863). Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл. 3. Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами a, b и g между ребрами (табл. 3). Величины a, b и с и a, b и g называются параметрами элементарной ячейки и однозначно ее определяют.
2. Физический признак кристаллов. В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: ионные, атомные, металлические, молекулярные.
Ионные кристаллы. В узлах кристаллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристаллами являются большинство галоидных соединений щелочных металлов (NaCl, CsCl, КВг и т. д.), а также оксидов различных элементов (MgO, CaO и т. д.). Структуры решеток двух наиболее характерных ионных кристаллов — NaCl (решетка представляет собой две одинаковые гранецентрированные кубические решетки, вложенные друг в друга; в узлах одной из этих решеток находятся ионы Na+, в узлах другой — ионы Cl-) и CsCl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки находится ион) — показаны на рис. 103.
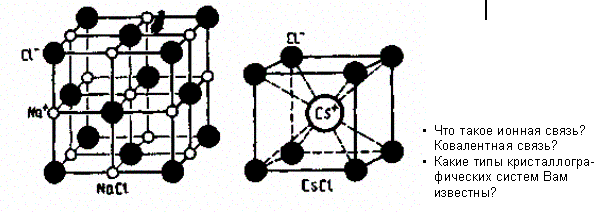
Рис. 103
Силы взаимодействия между ионами являются в основном электростатическими (кулоновскими). Связь, обусловленная кулоновскнми силами притяжения между разноименно заряженными ионами, называется ионной (или гетерополярной). В ионной решетке нельзя выделить от дельные молекулы: кристалл представляет собой как бы одну гигантскую молекулу.
Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеомолярными, или ковалентными, связями квантово-механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются ал маз и трафит (два различных состояния углерода), некоторые неорганические соединения (ZnS, BeO и т. д.), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. 104, где каждый атом углерода окружен четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдров.
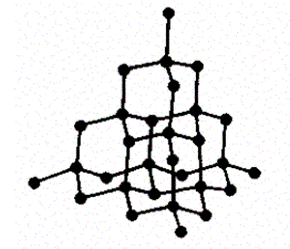
Рис. 104
Валентные связи осуществляются па рами электронов, движущихся по орбитам, охватывающим оба атома, и носят направленный характер: ковалентные силы направлены от центрального атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдвигать отдельные участки кристалла, по этому алмаз является прочным соединением.
Таблица 3
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае гомеополярной связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаотически, подобно молекулам газа, движутся «свободные» электроны, наличие которых обеспечивает хорошую электропроводность металлов. Так как металлическая связь не имеет направленного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию высокого порядка. Действительно, большинство металлов имеют кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрированную (Си, Ag, Pt, Аи) решетки. Чаще всего металлы встречаются в виде поликристаллов.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются ней тральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д.), инертные газы (Не, Аг, Кг, Хе) и газы СО2, О2) N2 в твердом состоянии, лед, а также кристаллы брома Вг2) иода I2. Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером может служить графит (гексагональная решетка). Решетка графита (рис. 105) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника.
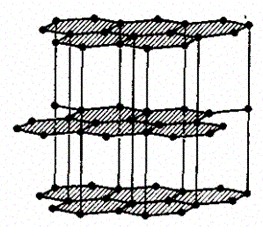
Рис. 105
Плоские слои связаны друг с другом ван-дер-ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным», коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя. Таким образом, в данном случае осуществляются три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван-дер-ваальсова — между слоями. Этим объясняется мягкость графита, так как его слои могут скользить друг относительно друга.
Различие в строении кристаллических решеток двух разновидностей углерода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т. д.
Расположение атомов в кристаллах характеризуется также координационным числом — числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. 106, а, б). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата. Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6, т. е. чем плотнее упаковка, тем больше координационное число.
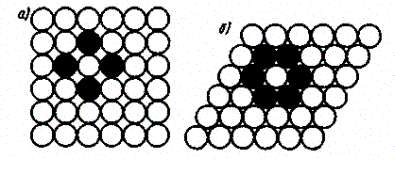
Рис. 106
Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. 106, б. Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их белыми кружками (рис. 107). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. 107 соответственно черными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В — если над красными кружками, слоем С — если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС..., в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
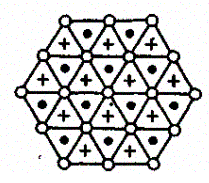
Рис. 107
Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ... —- гексагональная плотно-упакованная структура (рис. 108); 2) трехслойная упаковка ABC ABC... — кубическая гранецентрированная структура (рис. 109). В обеих решетках координационное число равно 12 и плотность упаковки одинакова — атомы занимают 74% общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. 104) равно 4.

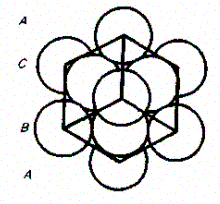
Рис. 108 Рис. 109
Кроме двух- и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАСАВСВАС... — шестислойная упаковка. Существует модификация карбида SiC с периодом повторяемости 6, 15 и 243 слоя.
Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. На рис. 110 приведено модельное изображение кристалла поваренной соли. Крупные ионы хлора (г =181 нм) образуют плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (г = 98 нм). Каждый ион Na окружен шестью ионами С1 и, наоборот, каждый ион С1 — шестью ионами Na.
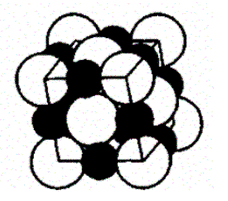
Рис. 110
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 753; Нарушение авторских прав?; Мы поможем в написании вашей работы!