
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Все химические реакции можно разбить на две группы: необратимые и обратимые. Реакции, которые протекают только в одном направлении и завершают полным превращением исходных реагирующих веществ в конечные вещества называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:

2KClO3 = 2KCl + 3O2
Реакция прекратиться тогда, когда весь KClO3 превратиться в KCl и O2. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
3H2 + N2 = 2NH3 ∆H= -46,2 кДж/моль
В технике обратимые реакции, как правило не выгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми: Признаки необратимости реакции: 1) образующиеся вещества уходят из сферы реакции – выпадают в виде осадка, выделяются в виде газа, например:
 BaCl2 + H2SO4 = BaSO4 + 2HCl
BaCl2 + H2SO4 = BaSO4 + 2HCl
 Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
2) образуется малодиссоциированное соединение, например вода:
HCl + NaOH= NaCl + H2O
3) Реакция сопровождается большим выделением энергии, например горение магния: 2Mg + O2 = 2MgO, ∆H= - 602,5 кДж/моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка. Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. Поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ – как исходных, так и образующихся – остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [H2], [N2], [NH3]. Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
H2 + 2 = 2HI
Согласно закону действия масс скорости прямой (Ѵ1) и обратной (Ѵ2) реакций выражают уравнениями:
Ѵ1 = K1[H2] [I2]; Ѵ2 = K2[HI]2
При равновесии скорости прямой и обратной реакций равны, откуда
K1[H2] [I2] =K2[HI]2 или K1/K2 = [HI]2/[H2] [I2]
Отношение констант скорости прямой и обратной реакции тоже представляет собой константу. Она называется константой равновесия данной реакции
(K): K1/K2 = K
Отсюда следует:
K=[HI]2/[H2] [I2]
При постоянной температуре (K) обратимой реакция представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ, в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия. В случае гетерогенных реакций, например для реакции
CO2+C=2CO
K имеет вид K=[CO]2/[CO2], как видим входят концентрации только тех веществ, которые находятся только в газовой фазе (возможно в жидкой фазе.
Величина (K) зависит от природы реагирующих веществ и от T. От присутствия катализатора не зависит. Поскольку катализатор энергию активации и прямой, и обратной реакции на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, T, а для газообразных веществ и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяет до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Направление смещение химического равновесия при изменениях концентрации реагирующих веществ, T и P (в случае газовых реакций) определяется общим положением, известным под названием принципы подвижного равновесия или принципа Ле Шателье: Если на систему, находящуюся в состоянии равновесия, производится какое-либо внешнее воздействие (изменится концентрация, T, P), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
1) Влияние изменения концентрации какого-либо из веществ на смещении равновесия. Рассмотрим реакцию H2 + I2 = 2HI Пусть пары I2, H2 и HI находятся в равновесии друг с другом при определенных T и P. Введем в систему дополнительно некоторое количество H2. Увеличение концентрации количества H2 благоприятствует реакции, вызывающей уменьшение концентрации этого вещества, и, следовательно равновесие сместится в сторону образования йодоводорода или вправо. Тоже самое наблюдаем при увеличении концентрации I2. Соответственно увеличение концентрации HI смещает равновесии в сторону исходных веществ или влево. Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого – либо из веществ равновесие смещается в сторону образования этого вещества
2) Влияние T на смещение химического равновесия. Рассмотрим синтез аммиака
N2+3H2=2NH3 ∆H= -46,2 кДж/моль
Эта реакция экзотермическая. Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышения T смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесия сместится в сторону исходных веществ, т.е. влево. Понижение T вызовет смещение равновесия в сторону продукта реакции, т.е. вправо. Синтез оксида азота (II) N2+O2=2NO ∆H=+….., представляет собой эндотермическую реакцию. Поэтому при повышении T равновесие сместится вправо в сторону образования NO. При понижении T – влево.
3) Влияние давления на смещение равновесия.
Чтобы определить влияние давления на смещение равновесия необходимо подсчитать число молекул в левой и правой частях уравнения. В уравнении для синтеза аммиака:
N2+BH2 = 2NH3 в левой части уравнения содержится четыре молекулы, а в правой две. Поскольку увеличение давления должно благоприятствовать процессу ведущему к уменьшению числа молекул, то в данном случае равновесие сместится в сторону исходных веществ. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например N2+O2 = 2NO, то изменение давления не вызывает смещения химического равновесия. Способы смещения равновесия в желательном направлении, основанные на принципе Ле Шателье, играют огромную роль в химии. Синтез аммиака многие другие промышленные процессы были освоены благодаря применению способов смещения равновесия в направлении, обеспечивающем высокий выход получаемого вещества.
Пример 1. Во сколько раз измениться скорость прямой и обратной реакции в системе 2SO2 (г)+ О2 (г) ↔ 2SO3 (г), если объём газовой смеси уменьшить в три раз? В какую сторону измениться равновесие системы?
Решение. Обозначим концентрации реагирующих веществ [SO2]=a, [O2]=b, [SO3]=c. Согласно закону действия масс скорости прямой и обратной реакции до изменения объёма

После уменьшения объёма гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2]=3a, [O2]=3b, [SO3]=3c. При новых концентрациях скорости (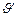 ) прямой и обратной реакции:
) прямой и обратной реакции:
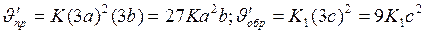
Отсюда

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - только в девять раз. Равновесие системы сменилось в сторону образования SO3.
Пример 2. В системе А (г.) + 2В (г.) = С (г.) равновесные концентрации равны: 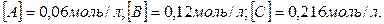 Найти константу равновесия реакции и исходные концентрации вещества А и В.
Найти константу равновесия реакции и исходные концентрации вещества А и В.
Решение. Константа равновесия данной реакции выражается уравнением:
 .
.
Подставляя в него данные задачи, получаем:
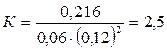

Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, 1 моля А и 2 молей В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 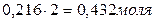 В. Таким образом, искомые исходные концентрации равны:
В. Таким образом, искомые исходные концентрации равны:
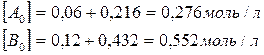
Пример 3. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле



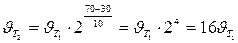
Следовательно, скорость реакции (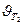 ) при температуре 70оС больше скорости реакции (
) при температуре 70оС больше скорости реакции ( ) при температуре 30оС в 16 раз.
) при температуре 30оС в 16 раз.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
151. Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если а) увеличить давление в системе в два раза и б) увеличить объем газовой смеси в три раза? Ответ: а) в 16 раз; б) в 81 раз
152. Вычислите температурный коэффициент скорости реакции, зная, что с повышением температуры на 60 °С скорость возрастает в 128 раз. Ответ: 6
153. Окисление аммиака идет по уравнению 4NH3 + 5O2 D 4NO + 6H2O. Через некоторое время концентрации веществ были равны следующим значения (моль/л): [NH3]t = 0,009; [O2]t = 0,002; [NO]t = 0,003. Вычислите концентрацию водяного пара в этот момент и исходные концентрации аммиака и кислорода. Ответ: D[H2O] = 0,0045 моль/л; [NH3]исх. = 0,012 моль/; [O2]исх. = 0,0238 моль/л.
154. Равновесие системы 2SO2 + O2 D 2SO3 установилось, когда концентрации компонентов (моль/л) были: [SO2]равн. = 0,6; [O2]равн. = 0,24; [SO3]равн. = 0,21. Вычислите константу равновесия этой реакции и исходные концентрации кислорода и диоксида серы. Ответ: К= 0,51; [SO2]исх = 0,81 моль/л; [O2]исх. = [O2]равн. + [O2]изр. = 0,24 + 0,105 = 0,345 моль/л.
155. В каком направлении сместится равновесие в реакциях при повышении температуры, понижении давления и увеличении концентрации водорода? а) CO(г) + H2O(г) D CO2(г) + H2(г), DH0 = -41,84 кДж; N2(г) + 3H2(г) D 2NH3(г), DH0 = 92,40 кДж; H2(г) + S(тв) D H2S(г), DH0 = -20,50 кДж
156. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г)  2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
157. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2. Ответ: в 16 раз.
158. Константа равновесия гомогенной системы: СО(г) + Н2О(г)  СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
159. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCl5(г)  РСl3(г) + Сl(г); D Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
РСl3(г) + Сl(г); D Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
160. Как изменится скорость реакции 2NO(г) + O2(г)= 2NO2(г), если общее давление в системе уменьшить в 5 раз? Ответ: Увеличилась в 125 раз
161. В какую сторону сместится равновесие в реакции: CO2 (г) + C (тв) = 2 CO (г); D H ° > 0 а) при повышении температуры; б) при увеличении давления? Напишите выражение для константы равновесия.
162. Реакция в газовой фазе протекает по уравнению: А + В «2С. Определить равновесные концентрации реагирующих веществ, если исходные концентрации (моль/л): [А] = 4; [В] = 6; константа равновесия К = 1. Ответ: [А] = 2,1 моль/л; [В] = 4,1 моль/л; [С] = 3,8 моль/л.
163. Константа скорости реакции при 283 К равна 1,08. 10–4, а при 333 К равна 5,484. 10–2. Вычислить энергию активации и константу скорости реакции при 303 К. Ответ: ЕА = 97600 кДж/моль; К303 = 1,67 * 10-3
164. Написать выражения закона действия масс для реакций: а) 2NO(г) + Cl2(г) = 2NOCl(г); б) СаСО3(к) = СаО(к) + СО2(г). Как изменится скорость реакции 2NO(г) + О2(г) = 2NO2(г), если уменьшить объем реакционной смеси в три раза? Ответ: возрастет в 27 раз.
165. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20 до 75 0С? Ответ: увеличится в 287 раз.
166. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны: [А] = 0,06 моль/л, [В] = 0,12 моль/л, [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В. Ответ: К = 2,5; [А0] = 0,276 моль/л; [В0] = 0,552 моль/л.
167. Как изменится скорость реакции 2NO(г.)+O2(г.)→2NO2(г.) если уменьшить объём реакционного сосуда в 3 раза? Ответ: возросла в 27 раз.
168. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 20 до 75 0С? Ответ: в 287 раз.
169. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастёт скорость реакции в присутствии катализатора, если реакция протекает при 298 К. Ответ: возросла в 25 тысяч раз.
170. При некоторой температуре константа диссоциации йодовродорода на простые вещества равна 6,25·10-2. Какой процент HI диссоциирует при этой температуре? Ответ: 33,3%
171. В каком направлении сместится равновесие в системах а) СО(г.)+Сl2(г.)↔СОСl2(г.) б) 2HI(г.)↔H2(г.)+I2(г.), если при неизменной температуре увеличить давление газовой смеси.
172. Используя справочные данные, найти значение температуры, при которой константа равновесия реакции образования водяного газа равна единице. С(графит) + Н2О(г.) ↔ СО(г.) + Н2(г.). Ответ: 983 К.
173. Реакция идет по уравнению СО(г) + Н2О(г) = СО2(г) + Н2(г). Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]0= 3моль/л, [H2O]0 = 2моль/л. Ответ: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] = 1,8 моль/л; [H2O] = 0,8 моль/л.
174. При некоторых условиях равновесие реакции СО+Н2О ↔ Н2 +СО2 установилось при следующих концентрациях: [СО]г=1 моль/л; [Н2О]г =4 моль/л; [Н2]г=2 моль/л; [СО2]г =2 моль/л. В какую сторону сместится равновесие при повышении концентрации СО в 3 раза? При какой концентрации установится новое равновесие? Ответ: [СО] =2,27 моль/л; [Н2О] = 3,27 моль/л; [СО2] = 2.73 моль/л; [Н2] = 2.73 моль/л
175. В каком направлении сместится равновесие в системе при понижении температуры и уменьшении объема: CO2 + C(Т) = 2 CO – Q. Ответ обосновать.
176. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при 5080С равна 0,16. Исходные концентрации реагирующих веществ были: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [Н2] стала равной 0,03 моль/л. Ответ: V0 = 320 * 10-6; V = 182 * 10-6
177. Напишите выражение для константы равновесия гомогенной системы: N2 + H2 ↔.2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в 3 раза? Ответ: увеличится в 9 раз
178. Как изменится равновесие в системе при повышении температуры и давления в газовой смеси: PCl5 (Г) ↔ PCl3 (Г)+ Cl2(Г), ∆Н = 92,6? Ответ обосновать.
179. Как изменится скорость реакции 2NO(г) + O2(г) → 2NO2(г), если увеличить давление в системе в 3 раза? Ответ: увеличится в 27 раз
180. Реакция идет по уравнению N2 + 3H2 ↔.2NH3. Концентрации участвующих в ней веществ были [N2]0 = 0,8 моль/л, [H2]0 = 1,5 моль/л, [NH3]0 = 0,1 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [Н2] = 0,6 моль/л; [NH3] = 0,7 моль/л
РАЗДЕЛ 7. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3232; Нарушение авторских прав?; Мы поможем в написании вашей работы!