
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Vщ = 31 см3 по з-ну эквивалентов: Снщ * Vщ = Снк * Vк
|
|
|
|
Дано:
Vщ = 31 см3 по з-ну эквивалентов: Снщ * Vщ = Снк * Vк
Снщ = 0,16 н Снк = Снщ * Vщ / Vк, отсюда
Vк = 217 см3 Снк = 0,16н 31 см3 / 217 см3 = 0,02н
Снк =? Снк = mк / Эк * V; mк = Снк * Эк х V
титр -? Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г/моль
mк = 0,02 * 49 * 1л = 0,98 г
T = mк / V; Т = 0,098 / 1000 мл = 0,00098 г/мл
Ответ: Снк = 0,02 н; титр = 0,00098 г/мл
Температуры кристаллизации, замерзания и кипения растворов:
Раствор кипит при более высокой и замерзает при более низкой температуре, чем растворитель. Повышение температуры кипения и понижение температуры замерзания растворов прямо пропорционально их моляльной концентрации:
∆t0кип = ЕСm; ∆t0зам = КСm,
где
∆t0кип - повышение температуры кипения;
∆t0зам - понижение температуры замерзания;
Е - эбуллиоскопическая константа;
К - криоскопическая константа;
Сm - моляльная концентрация раствора.
Сm = 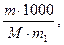
где m - масса растворенного вещества в 1000 г растворителя;
M - молекулярная масса растворенного вещества;
m 1 - масса растворителя.
Подставив С m в уравнение (I), получим:
∆t0кип = Е 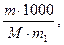 ∆t0зам = К
∆t0зам = К 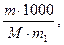
Зная t 0кип или t 0зам можно найти молекулярную массу растворенного вещества (М), эбуллиоскопическую (Е) или криоскопическую (К) константы.
Например. Определить температуру кипения 10% - го растворы глюкозы в воде. Е  = 0,52 0.
= 0,52 0.
Решение. В 10% - ом растворе глюкозы в 100г раствора содержится 10г глюкозы и 90 г растворителя. Подставив конкретные значения:
Е  = 0,52 0, m = 10г; m 1 = 90г
= 0,52 0, m = 10г; m 1 = 90г
М 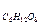 = 180 в уравнение (II), получим
= 180 в уравнение (II), получим
t 0кип = 0,52 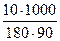 = 0,320 0
= 0,320 0
Вода кипит при р = 760 мм.рт.ст. при 100 0 С, поэтому температура кипения раствора равна 100 + 0,32 = 100,32 0 С.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
181. К 1 литру раствора с массовой долей HCl 20 % (ρ = 1,100 г/см3) добавили 400 см3 раствора с массовой долей HCl 5 % (ρ = 1,024 г/см3). Вычислите массовую долю HCl в полученном растворе. Ответ: 15,93%
182. Вычислить молярную концентрацию раствора сульфата калия,
20 мл которого содержат 1,74 г этой соли. Ответ: 0,5моль/л.
183. Сколько граммов оксида кальция содержится в 200 мл 0,3 н. раствора? Рассчитать титр раствора. Ответ: 37 г/моль; Т = 0,0111 г/мл.
184. Вычислить температуры кристаллизации, и кипения раствора с массовой долей сахара C12H22O11 = 5 %. Ответ: 0,060С; 100,060С
185. Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина? Ответ: 2,150С.
186. В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С? Ответ: 289 г
187. При растворении 6,9 г глицерина в 500 г воды температура замерзания понизилась на 0,279 °С. Определите молярную массу глицерина. Ответ: 92 г/моль
188. Вычислите: а) процентную (С %); б) молярную (СM); в) эквивалентную (Сн); г) моляльную (См) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр T этого раствора? Ответ: С% = 6%; б) СM = 0,63 М; в) Сн = 1,89 Н; г) См = 0,65 м; Т = 0,06186 г/см3.
189. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты? Ответ: 0,25Н
190. К 1 л 10%-ного раствора КОН (ρ = 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
191. Какой объем 96%-ной кислоты (ρ = 1,84 г/см3) потребуется для приготовления 3 л 0,4 н раствора? Ответ: 33,32 см3
192. В какой массе воды надо растворить 44,8 л HCl (объем измерен при н. у.), чтобы получить 26 %-й раствор HCl? Ответ: 207,8 г
193. Какую массу воды надо прибавить к 3 моль К2SO4. 7H2O, чтобы получить 9 %-й раствор К2SO4? Ответ: 4900 г
194. Какой объем 0,3 М раствора Na3(PO4)2можно приготовить из 250 мл 1,5 н. раствора? Ответ: 417 мл
195. Плотность 12 %-го раствора Na2SO3равна 1,08 г/мл. Вычислить моляльность, молярность и эквивалентную концентрацию (нормальность) этого раствора. Ответ: Ст = 1,08 т; СМ = 1,03 М; СН = 2,06 Н
196. Сколько граммов поваренной соли и воды необходимо для приготовления 2 кг 20 % - го раствора? Ответ: 400 г соли; 1600 г воды
197. Сколько граммов КОН нужно взять для приготовления 500 мл 0,1М раствора? Ответ: 2,8 г
198. Сколько миллилитров 96 %-ной H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1 л 0,5 н. раствора? Ответ: 13,84 мл
199. Вычислить температуру замерзания раствора содержащего 54 г глюкозы С6Н12О6 в 250г воды. Криоскопическая константа воды равна 1,86 0С. Ответ: - 2,230С
200. К 1л 10%-ного раствора КОН (ρ = 1,092г/см3) прибавили 0,5л 5%-ного раствора КОН (ρ = 1,045г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
201. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце. Ответ: 24,8%
202. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7; 34,8 и 40,5%. Ответ: KMnO4.
203. Сколько литров 6 н раствора NaOH следует добавить к 4,5 литрам 0,8 н раствора NaOH, чтобы смешанный раствор оказался двунормальным? Ответ: 1,35 л
204. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Чему равна процентная концентрация полученного раствора? Ответ: 45,57%
205. Вычислите молярную и эквивалентную концентрации 49% раствора H3PO4 плотностью 1,33 г/мл. Ответ: Cм = 0,6 М; Cн = 2 Н
206. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г
207. Сколько граммов 3% раствора MgSO4 можно приготовить, растворив в воде MgSO4 . 7H2O? Ответ: 16,3 г
208. Какой объем 10% раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 5 л 2% раствора (ρ = 1,02 г/мл)? Ответ: 0,9 л
209. К 3 л 10% раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2% раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л. Ответ: 5,082%; СМ = 0,83М
210. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г; ТNaOH = 0,016 г/мл
РАЗДЕЛ 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления - характерный признак ОВР.
Протекание химических реакций в целом обусловлено обменом частицами между реагирующими веществами. Часто обмен сопровождается переходом электронов от одной частицы к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
Zn (т) + CuSO4 (р) = ZnSO4 (p) + Cu (т)
электроны от атомов цинка переходят к ионам меди:
Zn (т) = Zn2+ (p) + 2 e,
Cu2+ (р) + 2 e = Cu (т),
или суммарно: Zn (т) + Cu2+ (р) = Zn2+ (p) + Cu (т).
Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Для удобства описания окислительно-восстановительных реакций используют понятие степени окисления (n) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов). Следует помнить, что величина n выражается не в кулонах, а в количестве отданных (принятых) электронов. Заряд одного электрона равен –1.60218·10-19Кл.
Протекание окислительно-восстановительныхреакций сопровождается изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем, вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
1. степень окисления элемента в простом веществе равна нулю;
2. алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
3. алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
4. отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
5. максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической таблице Д.И. Менделеева.
6. В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая степень окисления
7. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные степени окисления
8. Постоянную степень окисленности в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы (+2)
9. При определении степени окисления предпочтение отдают элементу, который располагается в таблице выше. Например, в CaO2: n(Сa) = +2, n(О) = - 1
10. степень окисленности кислорода в соединениях равна –2, за исключением пероксидов (-1) и фторида кислорода OF 2 (+2).
11. водород проявляет степень окисленности +1 во всех соединениях, кроме гидридов металлов (NaH, CaH 2 и т.п.), где степень окисленности равна –1;
Ряд элементов в соединениях проявляют постоянную степень окисления, что используют при определении степеней окисления других элементов:
1) фтор, имеющий наивысшую среди элементов электроотрицательность, во всех соединениях имеет степень окисления –1;
2) водород в соединениях проявляет степень окисления +1, кроме гидридов металлов (–1);
3) металлы IA подгруппы во всех соединениях имеют степень окисления +1; 4) металлы IIA подгруппы, а также цинк и кадмий во всех соединениях имеют степень окисления +2;
4) степень окисления алюминия в соединениях +3;
5) степень окисления кислорода в соединениях равна –2, за исключением соединений, в которых кислород присутствует в виде молекулярных ионов: О2+, О2-, О22-, О3-, а также фторидов O x F2.
Степени окисления атомов элементов в соединении записывают над символом данного элемента, указывая вначале знак степени окисления, а затем ее численное значение, например, 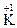
 4, в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe2+, SO42–.
4, в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe2+, SO42–.
Окислительно-восстановительные свойства атомов различных элементов проявляются в зависимости от многих факторов, важнейшие из которых – электронное строение элемента, его степень окисления в веществе, характер свойств других участников реакции. Соединения, в состав которых входят атомы элементов в своей максимальной (положительной) степени окисления, например, K 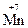 O4, K2
O4, K2 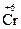 2O7, H
2O7, H 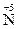 O3,
O3, 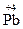 O2, могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например,
O2, могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например, 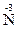 H3, H2
H3, H2 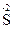 , H
, H 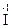 , могут только окисляться и выступать в качестве восстановителей. Вещества, содержащие элементы в промежуточных степенях окисления, например H
, могут только окисляться и выступать в качестве восстановителей. Вещества, содержащие элементы в промежуточных степенях окисления, например H 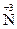 O2, H2
O2, H2 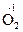 ,
, 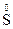 ,
, 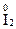 ,
, 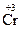 Cl3,
Cl3, 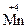 O2, обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать, и отдавать электроны. Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу. Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие соединения переходят окислитель и восстановитель.
O2, обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать, и отдавать электроны. Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу. Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие соединения переходят окислитель и восстановитель.
Важнейшие окислители. Галогены, восстанавливаясь, приобретают степень окисления –1, причем от фтора к йоду их окислительные свойства ослабевают (F2 имеет ограниченное применение вследствие высокой агрессивности):
2H2O + 2F2 = O2+ 4HF
Кислород O2, восстанавливаясь, приобретает степень окисления –2:
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
Азотная кислота HNO3 проявляет окислительные свойства за счет азота в степени окисления +5:
3Сu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4H2O
При этом возможно образование различных продуктов восстановления:
NO3– + 2H+ + e = NO2 + H2O
NO3– + 4H+ + 3 e = NO + 2H2O
NO3– + 5H+ + 4 e = 0,5N2O + 2,5H2O
NO3– + 6H+ + 5 e = 0,5N2 + 3H2O
NO3– + 10H+ +8 e = NH4+ + 3H2O
Глубина восстановления азота зависит от концентрации кислоты, а также от активности восстановителя:
Концентрация кислоты
¾¾¾¾¾¾¾¾¾¾¾¾¾
NO2 NO N2O N2 NH4+
¾¾¾¾¾¾¾¾¾¾¾¾¾®
Активность восстановителя
Соли азотной кислоты (нитраты) могут восстанавливаться в кислотной, а при взаимодействии с активными металлами и в щелочной средах, а также в расплавах:
Zn + KNO3 + 2KOH 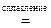 K2ZnO2 + KNO2 + H2O
K2ZnO2 + KNO2 + H2O
Царская водка – смесь концентрированных азотной и соляной кислот, смешанных в соотношении 1:3 по объему. Название этой смеси связано с тем, что она растворяет даже такие благородные металлы как золото и платина:
Au + HNO3(конц) + 4HCl(конц) = H[AuCl4] + NO+ 2H2O
Серная кислота H2SO4 проявляет окислительные свойства в концентрированном растворе за счет серы в степени окисления +6:
C(графит) + 2H2SO4 (конц)  СO2 + 2SO2 + 2H2O.
СO2 + 2SO2 + 2H2O.
Состав продуктов восстановления определяется главным образом активностью восстановителя и концентрацией кислоты:
SO42– + 4H+ + 2 e = SO2 + 2H2O
SO42– + 8H+ + 4 e = S+ 4H2O
SO42– +10H+ + 8 e = H2S + 4H2O
Концентрация кислоты
¾¾¾¾¾¾¾¾¾¾¾¾¾
H2S S SO2
¾¾¾¾¾¾¾¾¾¾¾¾¾
Активность восстановителя
Кислородсодержащие кислоты галогенов и их соли часто используются как окислители, хотя многие из них проявляют двойственный характер. Как правило, продуктами восстановления этих соединений являются хлориды и бромиды, а также йод:
MnS + 4HСlO = MnSO4 + 4HCl;
5Na2SO3 + 2HIO3 = 5Na2SO4 + I2 + H2O
Перманганат калия KMnO4 проявляет окислительные свойства за счет марганца в степени окисления +7. В зависимости от среды, в которой протекает реакция, он восстанавливается до разных продуктов: в кислотной среде – до солей марганца (II), в нейтральной – до оксида марганца (IV) в гидратной форме MnO(OH)2, в щелочной – до манганат-иона MnO42–:
кислотная среда:
5Na2SO3 +2KMnO4+ 3H2SO4(разб)= 5 Na2SO4 + 2MnSO4 +3H2O+K2SO4
нейтральная среда:
3Na2SO3 + 2KMnO4 + 3H2O = 3Na2SO4 + 2MnO(OH)2¯+ 2KOH
щелочная среда:
Na2SO3 + 2KMnO4+ 2KOH = Na2SO4 + 2K2MnO4 + H2O
Дихромат калия K2Cr2O7, в состав молекулы которого входит хром в степени окисления +6, является сильным окислителем при спекании и в кислотном растворе:
6KI + K2Cr2O7 + 7H2SO4 (разб) = 3I2 + Cr2(SO4)3 + 7H2O + 4K2SO4
проявляет окислительные свойства и в нейтральной среде:
3H2S + K2Cr2O7 + H2O = 3S¯ + 2Cr(OH)3¯ + 2KOH.
Среди ионов окислительные свойства проявляют ион водорода Н+ и ионы металлов в высшей степени окисления. Ион водорода Н+ выступает как окислитель при взаимодействии активных металлов с разбавленными растворами кислот (за исключением HNO3): Mg + H2SO4 (разб) = MgSO4 + H2
Ионы металлов в относительно высокой степени окисления, такие, как Fe3+, Cu2+, Hg2+, восстанавливаясь, превращаются в ионы более низкой степени окисления:
H2S + 2FeCl3 = S¯ + 2FeCl2 + 2HCl
или выделяются из растворов их солей в виде металлов:
2Al + 3CuCl2 = 2AlCl3 + 3Cu.
Важнейшие восстановители. К типичным восстановителям среди простых веществ относятся активные металлы, такие как щелочные и щелочно-земельные металлы, цинк, алюминий, железо и др., а также некоторые неметаллы (водород, углерод, фосфор, кремний): Zn + 2HCl = ZnCl2 + H2
C + 4HNO3(конц, гор) = CO2 + 4NO2 + 2H2O
Восстановительными функциями обладают бескислородные анионы, такие как Cl-, Br-, I-, S2-, H-, и катионы металлов в низшей степени окисления:
2HBr(конц) + Н2O2(конц) = Br2 + 2H2O;
2CaH2 + TiO2 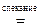 2CaO + Ti +2H2.
2CaO + Ti +2H2.
2FeSO4 + H2O2(конц)+ H2SO4(разб)  Fe2(SO4)3 + 2H2O.
Fe2(SO4)3 + 2H2O.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 929; Нарушение авторских прав?; Мы поможем в написании вашей работы!