
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состояние электронного облака атома углерода
Атом углерода, его особенности, валентные состояния
Вводная лекция
Органическая химия – химия атома углерода. Число соединений на уго основе (органических соединений) в десятки раз больше, чем неорганических, что может быть объяснено только особенностями атома углерода:
а) он находится в середине шкалы электроотрицательности и второго периода, поэтому ему невыгодно отдавать свои и принимать чужие электроны и приобретать положительный или отрицательный заряд;
б) он имеет особенное строение валентной электронной оболочки в возбужденном состоянии – нет электронных пар и свободных орбиталей (есть еще только один атом с подобным строением – водород, вероятно, поэтому углерод с водородом образует столь много соединений - углеводородов).
- в невозбужденном состоянии электронная формула имеет вид:
С – 1s22s22p2 или 1s22s22px12py1 2pz0
В графическом виде: 
- в возбужденном состоянии:
*С – 1s22s12p3 или 1s22s12px12py1 2pz1
В виде ячеек: 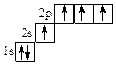
- Форма s- и p – орбиталей


Атомная орбиталь - область пространства, где с наибольшей вероятностью можно обнаружить электрон, с соответствующими квантовыми числами.
Относительные размеры атомных орбиталей увеличиваются по мере возрастания их энергий (главное квантовое число - n), а их форма и ориентация в пространстве определяется – квантовыми числами l и m. Электроны на орбиталях характеризуются спиновым квантовым числом. На каждой орбитали могут находиться не более 2 электронов с противоположными спинами.
При образовании связей с другими атомами электронная оболочка атома углерода преобразуетсятак, чтобы образовались наиболее прочные связи, а, следовательно, выделилось как можно больше энергии, и система приобретала наибольшую устойчивость.
Энергия, затраченная на изменение электронной оболочки атома, затем компенсируется за счет образования более прочных связей.
Различают 3 типа преобразования электронной оболочки (гибридизации) углерода, в зависимости от числа атомов, с которыми он образует связи.
Виды гибридизации атома углерода:
sp3 – Гибридизация (валентное состояние) – углерод образует связи с 4 соседними атомами (тетраэдрическая гибридизация):
Электронная формула sp3 – гибридного атома углерода:
*С –1s22(sp3)4 в виде ячеек 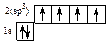 .
.
В гибридизации участвуют одна s- и три p-орбитали, которые суммируются и образуют четыре sp3 – гибридных орбитали, направленные к углам правильного тетраэдра.

Валентный угол между гибридными орбиталями ~109°.
Стереохимическая формула атома углерода:
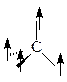
sp2 – Гибридизация (валентное состояние) – атом образует связи с тремя соседними атомами (тригональная гибридизация):
Электронная формула sp2 – гибридного атома углерода:
*С –1s22(sp2)32p1 в виде ячеек 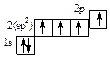

В гибридизации участвуют одна s- и две p-орбитали, которые суммируются и образуют три sp2 – гибридных орбитали, расположенные в одной плоскости. Оставшаяся p-орбиталь расположена перпендикулярно этой плоскости.
Валентный угол между гибридными орбиталями ~120°.
Стереохимическая формула sp2 – гибридного атома углерода:

sp – Гибридизация (валентное состояние) – атом образует связи с 2 соседними атомами (линейная гибридизация):
Электронная формула sp – гибридного атома углерода:
*С –1s22(sp)22p2 в виде ячеек 
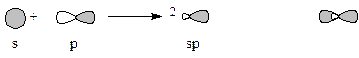
Валентный угол между гибридными орбиталями ~180°.
Стереохимическая формула:

Во всех видах гибридизации участвует s-орбиталь, т.к. она имеет минимум энергии.
Перестройка электронного облака позволяет образовывать максимально прочные связи и минимальное взаимодействие атомов в образующейся молекуле. При этом гибридные орбитали могут быть не идентичные, а валентные углы – разные, например СН2Cl2 и СCl4
|
|
Дата добавления: 2014-10-15; Просмотров: 1445; Нарушение авторских прав?; Мы поможем в написании вашей работы!