
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетика реакции
|
|
|
|
Любая система стремится к наиболее устойчивому состоянию, поэтому, чем более устойчивы продукты реакции по сравнению с исходными веществами, тем более равновесие между ними будет смещено в сторону продуктов, т. е. чем больше разница в устойчивости, тем в большей степени исходные вещества должны превращаться в продукты.
Однако, простого изменения общей энергии (энтальпии) при переходе от исходных веществ к продуктам реакции недостаточно для определения их устойчивости.

В соответствии со вторым законом термодинамики, упорядоченные системы стремятся к разупорядочению. Мерой степени разупорядоченности системы является ее энтропия.
В поисках наибольшей устойчивости системы стремятся к минимальному значению энергии (т. е. к минимуму энтальпии) и к максимуму энтропии (беспорядок или случайность). Таким образом, условия, отвечающие относительной устойчивости системы, должны определяться компромиссом между значениями Н и S, что выражается свободной энергией Гиббса G, определяемой уравнением:
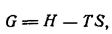 где Т – абсолютная температура
где Т – абсолютная температура
Изменение свободной энергии в ходе реакции при данной температуре:

Показано, что стандартное изменение свободной энергии при переходе от исходных веществ к продуктам реакции, ΔG° (ΔG° характеризует изменение свободной энергии в стандартных условиях: при активности, равной единице; менее точно—в расчете на 1 моль при давлении 1 атм) связано с константой равновесия К уравнением:
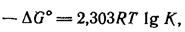
т. е. чем сильнее уменьшается свободная энергия (поэтому минус ΔG°) при переходе от исходных веществ к продуктам реакции, тем больше К и тем больше равновесие сдвинуто в сторону продуктов реакции.
Очевидно, что минимальное значение свободной энергии соответствует равновесию между исходными веществами и продуктами реакции. В реакции, в которой свободная энергия не изменяется (ΔG° = 0), К= 1, что соответствует 50 %-му превращению исходных веществ в продукты реакции. Возрастанию положительных значений ΔG° соответствует быстрое уменьшение К (поскольку эта величина стоит под знаком lg), соответствующее чрезвычайно малому превращению исходных веществ в продукты, и наоборот, возрастанию отрицательных значений ΔG° соответствует быстрое увеличение К. Так, изменению свободной энергии ΔG°, равному —42 кДж/моль, соответствует значение константы равновесия, равное ~ 107, т. е. исходные вещества практически полностью превращаются в продукты реакции. Знание стандартных свободных энергий исходных веществ и продуктов, которые определены для большого числа органических соединений, дает возможность предсказать ожидаемую степень превращения исходных веществ в продукты.
Вклад члена ΔН в изменение свободной энергии может быть оценен по разности энергии связей исходных веществ и продуктов; приблизительное значение ΔНдля данной реакции часто может быть предсказано, исходя из табличных значений стандартных энергий связи. Вряд ли неожиданным является тот факт, что в первую очередь на основании данных ΔНбыли составлены таблицы средних значений энергий связи!
Энтропийный член не может быть объяснен так же просто, но его обоснованно связывают с числом возможных путей, с помощью которых суммарная энергия системы может быть распределена между составляющими ее молекулами, а также с числом возможных способов, при помощи которых энергия каждой молекулы может быть распределена на поступательную, вращательную и колебательную составляющие (из которых поступательная, вероятно, самая большая). Так, для реакции А=В + С, в ходе которой происходит увеличение числа частиц при переходе от исходных веществ к продуктам реакции, должна, вероятно, заметно возрастать энтропия из-за увеличения поступательных степеней свободы. В таких случаях член — ТΔ8 может оказаться достаточным для того, чтобы уравновесить член +ΔН в эндотермической реакции и обеспечить общее уменьшение свободной энергии АС; в результате состоянию равновесия будет соответствовать высокая концентрация продуктов. Если же реакции экзотермична (член ΔНотрицателей), то ΔG будет, конечно, даже более отрицателен, а константа равновесия К соответственно еще больше. Когда число реагирующих частиц уменьшается при переходе от исходных веществ к продуктам реакции, энтропия уменьшается (член ΔS отрицателен):
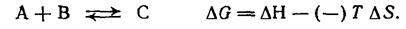
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 317; Нарушение авторских прав?; Мы поможем в написании вашей работы!