
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на доступность электронов
|
|
|
|
Факторы, влияющие на доступность электронов связей молекулы, могут очень сильно влиять на её реакционную способность. Область с высокой электронной плотностью атакуется электрофилом (катионом или частицей с низкой электронной плотностью), наоборот область с низкой электронной плотностью взаимодействует с нуклеофилами (анионами или частицей с высокой электронной плотностью). В настоящее время различают следующие факторы:
1. Индуктивный эффект – используется для характеристики электронного облака σ -связи
В случае ковалентной связи между двумя неодинаковыми атомами электронная пара σ -связь всегда несколько смещена к более электроотрицательному атому. Так, в алкилхлориде электронная плотность несколько выше на атоме хлора, а на атоме углерода – частичный положительный заряд:

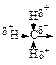
Эффект может передаваться по углеродной цепи, но в насыщенных углеводородах - на очень небольшие расстояния. Его можно определить лишь на С2.
Большинство атомов и групп атомов оттягивают электронное облако от атома углерода (отрицательный индуктивный эффект), наоборот, радикалы проявляют положительный индуктивный эффект (объяснить!).
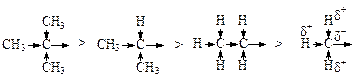
Индуктивные эффекты приводят к поляризации молекулы в ее основном состоянии и поэтому отражаются на ее физических характеристиках, например на дипольном моменте.
2. Мезомерный эффект – используется для характеристики электронного облака π –связи
Эффект сопряжения – частный случай мезомерного эффекта, когда π – электронное облако перераспределяется по трем и более p-орбиталям.
Например, свойства карбонильной группы полностью не описываются ни классической формулой, ни структурой, получаемой путем сдвига π –электронов к атому кислорода:
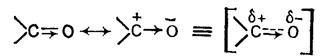
Действительная структура представляет собой нечто промежуточное, то есть гибрид (теория резонанса), для которого структуры (а) и (б) являются граничными формами. Здесь также возможен индуктивный эффект, но он гораздо меньше, чем мезомерный эффект, поскольку σ-электроны намного меньше поляризуются и поэтому менее подвижны, чем π-электроны.
Если группа С=О сопряжена со связью С=С, поляризация может передаваться дальше посредством π-электронов, как, например, для акролеина:

При этом происходит делокализация заряда, что приводит к нехватке электронов на атомах С-3 и С-1. В отличие от индуктивного эффекта при передаче по цепи эффект ослабляется в гораздо меньшей степени, а полярность соседних атомов углерода чередуется.
Эффект сверхсопряжения – перераспределение π (и p) – электронного облака под влиянием a-s-связей (в наибольшей степени a-С-Н s-связей)
Индуктивный эффект алкильных групп, как и следовало ожидать, уменьшается в следующем ряду:

Однако, если алкильные группы связаны с sp2 – гибридным атомом углерода, например с двойной связью или бензольным кольцом, этот порядок нарушается и в случае некоторых сопряженных систем изменяется на обратный. Это удалось объяснить предположив, что делокализация электронов происходит с участием электронов соседних a-s-связей (как С-Н, так и С-С).
Считается, что электронные облака a-s-связей (в наибольшей степени a-С-Н s-связей) могут перекрываться с π –электронным облаком, что приводит к перераспределению электронных облаков, стабилизации двойных связей, радикалов, катионов, анионов.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 425; Нарушение авторских прав?; Мы поможем в написании вашей работы!