
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие сведения о процессе сульфирования
|
|
|
|
В реакциях электрофильного замещения в ряду нафталина наиболее легко и преимущественно замещается a-водородный атом.
Электрофильное замещение в нафталине
Электрофил, атакуя p-электронное облако нафталина, так же образует p- и s-комплексы. s-Комплекс сохраняет ароматичность одного из циклов и стабильнее, чем карбокатионы бензола, поэтому нафталин активнее бензола в реакциях SE.
В отличие от бензола в нафталине реакция электрофильного замещения может иметь два направления.
Из двух возможных s-комплексов (I и II) преимущественно образуется более устойчивый.

Распределение заряда в s-комплексе I можно отразить двумя граничными структурами (а, б). В катионе II такой возможности распределения заряда нет. При этом мы рассматриваем лишь структуры, в которых сохраняется ароматичность одного из колец нафталина. Граничные структуры, в которых нарушена ароматичность обоих колец нафталина, неизмеримо менее устойчивы, чем указанные выше и мы их не учитываем.
ГЛАВА 1. МЕТОДЫ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ
СУЛЬФОКИСЛОТ И СУЛЬФОХЛОРИДОВ
Существуют разные методы введения группы –SO3H в молекулу органического соединения. Процесс прямого замещения атома водорода сульфогруппой, который наиболее широко применяется в промышленности, называют сульфированием. В зависимости от того, у какого элемента замещается атом водорода на сульфогруппу, различают С-, N- и О-сульфирование. О-Сульфирование называют также сульфатированием.
Субстратом (исходным веществом) при сульфировании служат, главным образом, ароматические и гетероароматические соединения и их производные. Реже используются вещества алифатического и алициклического ряда. Среди них наибольшее значение в синтезе сульфо-БАВ имеют полисахариды и стероиды. В ряде случаев сульфируются сами лекарственные вещества.
Основными сульфирующими агентами являются:
Безводная серная кислота — плавится при 10,4 °С, при комнатной температуре представляет собой тяжелую маслянистую жидкость, т.к. ее молекулы за счет водородных связей образуют полимер, который при повышении температуры разрушается:

Кипит она при температуре около 300 °С, перегоняется с разложением, образуя азеотропную смесь состава 98,3 % H2SO4 и 1,7 % Н2О (t кип = 338,8 °С). Жидкая 100 %-ая серная кислота является ионизирующим растворителем, однако, ее собственная ионизация незначительная:
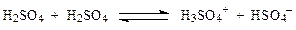
Серная кислота смешивается с Н2О и SO3 в любых соотношениях. В водных растворах она полностью диссоциирует на ионы:

Для промышленного сульфирования чаще всего используют купоросное масло (92—98 %-ную H2SO4) и 98—100 %-ную серную кислоту. Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании.
Олеум — образуется при растворении серного ангидрида в концентрированной серной кислоте и представляет собой раствор SO3 в смеси кислот: серной (H2SO4), двусерной (H2S2O7), трисерной (H2S3O10) и других полисерных кислот:
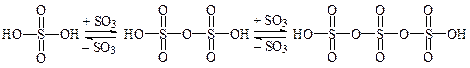
При концентрации сульфотриоксида 20—25 % и 60—65 % олеум представляет собой густую маслянистую, дымящуюся на воздухе жидкость. Олеум с другими концентрациями SO3 при комнатной температуре является твердым веществом, и его готовят из стандартного раствора непосредственно в реакторе.
Серный ангидрид — это общее название нескольких модификаций триоксида серы. Молекула SO3 существует в виде мономера, тримера и полимера (существуют и другие формы, например, димер):
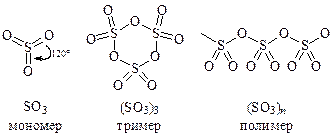
В газовой фазе и в разбавленных неводных растворах оксид серы (VI) находится в мономерной форме. При конденсации паров SO3 образуется летучая бесцветная жидкость (t кип = 44,8 °С), состоящая преимущественно из циклических тримерных молекул (SO3)3. При охлаждении до 16,8 °С она затвердевает с образованием прозрачных кристаллов. Эта форма SO3 неустойчива и при хранении превращается в устойчивые, похожие на асбест, нити. Полимеризацию SO3 предотвращают введением Р2О5 и других ингибиторов.
Для сульфирования серный ангидрид получают: а) обжигом пирита и последующим каталитическим окислением SO2 в SO3 непосредственно на предприятии, где он используется; б) на специализированных заводах с последующей доставкой на предприятие в баллонах под давлением в жидком стабилизированном виде; в) десорбцией из высокопроцентного олеума при нагревании. Остающаяся после десорбции серного ангидрида 100 %-ная серная кислота может быть использована в других производствах. Первый метод применяют на производствах большой мощности, например, заводах по синтезу поверхностно-активных веществ сульфированием (сульфатированием) первичных спиртов, олефинов, алкилбензолов и т. п. Остальные — на предприятиях с малой мощностью, например, на химико-фармацевтических заводах.
Область применения концентрированной серной кислоты ограничивается незамещенными и активированными аренами. Малоактивные субстраты сульфируются олеумом различной концентрации или сульфотриоксидом.

Сульфогруппа вводится в субстрат как с целью придания ему новых свойств (снижения токсичности лекарственного препарата, придания ему несколько иной биологической активности, повышения его растворимости в воде, что создает предпосылки для получения инъекционных лекарственных форм), так и с целью дальнейшей замены сульфогруппы на гидроксил, аминогруппу и т. п.
Целевым продуктом сульфирования аренов являются сульфоновые кислоты, которые называют, добавляя к названию основы окончание «сульфокислота» («сульфоновая кислота»), например, бензолсульфокислота, 2-нафталинсульфокислота.

При N- и O- сульфировании образуются амиды и эфиры серной кислоты.
Сульфокислоты, как правило, являются твердыми гигроскопичными кристаллическими веществами, хорошо растворимыми в воде. Это сильные кислоты, по константе диссоциации близкие к минеральным. В разбавленных водных растворах они диссоциируют практически нацело.
Число синтетических сульфокислот очень велико, и они широко используются в практике.
Из природных сульфокислот следует, прежде всего, отметить аминосульфокислоты: таурини цистеиновую кислоту, которые играют большую роль в процессе всасывания жиров в организме млекопитающих, а также сульфатированные фито- и зоополисахариды
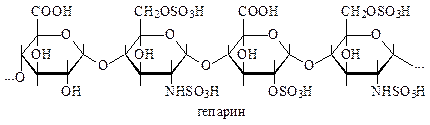
Гепарин— (сульфатированный зоогетерополисахарид, состоящий из глюкуроновой кислоты и глюкозамина) выпускается в качестве лекарственного препарата для регулирования свертываемости крови и лечения ряда других заболеваний.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 725; Нарушение авторских прав?; Мы поможем в написании вашей работы!