
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Минимальную концентрацию серной кислоты (выраженную в % SO3), при которой она еще способна сульфировать соединение, называют «p-сульфирования» (pс)
|
|
|
|
За величину «p-сульфирования» принимают концентрацию серной кислоты, при которой скорость образования продукта составляет менее 1 % за час.
На практике процесс ведут так, чтобы в конце сульфирования концентрация оставшейся серной кислоты была выше pс, так как, в противном случае, скорость реакции будет слишком мала.
Эта величина полезна также при определении массы реагента.
Минимальное количество серной кислоты или олеума, необходимое для моносульфирования 1 моль соединения, может быть вычислено по формуле:

где С — начальная концентрация сульфирующего агента в % SO3.
Чем выше концентрация исходной кислоты, тем меньше ее понадобится для проведения процесса. Однако следует иметь в виду, что повышение концентрации сульфирующего агента может привести к нежелательным побочным эффектам (образование полисульфокислот, сульфонов, окисление субстрата и т.д.).
При сульфировании нафталина концентрация серной кислоты может определять направление реакции, при этом из нафталина могут быть целенаправленно получены α- и β-нафталинсульфокислоты:

Для получения α-нафталинсульфокислоты рационально применять более концентрированную кислоту, чтобы предотвратить десульфирование продукта реакции. При получении β-нафталинсульфокислоты следует брать серную кислоту несколько меньшей концентрации, чтобы способствовать гидролизу побочного α-изомера (β-изомер в этих условиях не десульфируется).
Известно, что повышение температуры увеличивает скорость реакции. Так, для бензола и его гомологов повышение температуры на каждые 10 °С увеличивает скорость сульфирования в 1,5—2 раза (что определяется энергией активации, которая колеблется в довольно широких пределах).
Однако, повышая температуру с целью увеличения скорости реакции, необходимо помнить, что ее изменение сказывается и на структуре образующихся продуктов. Так, при сульфировании фенола серной кислотой при комнатной температуре образуется преимущественно орто -изомер, а при 100 °С — пара -изомер.

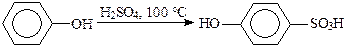

При обработке фенола, взятого в избытке, купоросным маслом при 160—180 °С получают 4,4'-дигидроксидифенилсульфон, образование которого объясняют электрофильной атакой ArSO2+ исходного субстрата. Наконец, при избытке сульфирующего агента возможно полисульфирование.
В связи с этим в зависимости от активности субстрата и желательного направления реакции процесс сульфирования ведут в одних случаях с нагревом, а в других — с охлаждением реакционной массы, при этом температура реакции может колебаться от –10 °С до 180 °С.
Продолжительность ведения процесса при одинаковых условиях также влияет на максимальный выход целевого продукта, поскольку процесс сульфирования описывается рядом параллельных и последовательных реакций (пример сульфирования нафталина).
Основные недостатки сульфирования серной кислотой:
1) малая концентрация электрофильных частиц;
2) быстрое снижение скорости реакции в процессе сульфирования (вследствие разбавления кислоты реакционной водой);
3) отсутствие возможности сульфирования малоактивных субстратов;
4) окислительные и агрессивные свойства реакционной среды;
5) технологические и экологические трудности на стадии выделения продукта (избыток сульфирующего агента приводит к необходимости использования больших количеств нейтрализующих средств, технологическому усложнению этой стадии и образованию большого количества отходов производства).
Некоторые из этих недостатков можно устранить удалением образующейся воды из реакционной массы. Ниже приведены наиболее широко применяемые в промышленности модификации метода.
«Сульфирование в парах» предполагает азеотропную отгонку воды из реакционной массы, либо с избытком летучего субстрата (бензолом, толуолом и др.), либо (в случае высококипящих углеводородов) со специально введенным в реакционную массу инертным азеотропным агентом (хлороформом, лигроином и др.).
При сульфировании бензола «в парах» расход серной кислоты снижается в 1,8 раза по сравнению с обычным сульфированием. Однако при этом снижается скорость сульфирования (вследствие уменьшения концентрации H2SO4 в реакционной массе) и процесс идет при более высокой температуре, необходимой для эффективного удаления воды.

Рис. 1. Аппаратурные схемы непрерывного и периодического сульфирования бензола «в парах»
1 — реактор, 2 — сепаратор, 3 — холодильник, 4 — испаритель
«Сульфирование запеканием» применяют для сульфирования ароматических аминов. Сначала из амина и разбавленной серной кислоты получают соль, которую выделяют и нагревают до 180—190 °С («запекают»). При этом образуется о - или п- аминосульфокислоты. Раньше «запекание» соли осуществляли в специальных печах. В настоящее время этот процесс проводят в среде полихлорбензолов:

При нагревании сульфата амина с полихлоридами бензола первоначально отгоняют азеотропную смесь воды с растворителем. Пары конденсируют, воду отделяют в отстойнике, а растворитель возвращают в реактор. Затем реакционную массу нагревают до 180 °С и выдерживают при кипении полихлорбензолов. По окончании процесса растворитель отгоняют, добавляют раствор NaOH и отгоняют с острым паром остатки полихлоридов и ароматического амина. Соль продукта остается в аппарате.
Таким образом, получают сульфаниловую (1) и нафтионовую кислоты (2), 4-амино-2,5-дихлор- (3) и 4-диметиламинобензолсульфокислоту (4).

Основными недостатками метода являются его ограниченность (применяется только для сульфирования ароматических аминов), энергоемкость и многостадийность.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 651; Нарушение авторских прав?; Мы поможем в написании вашей работы!