
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сульфирование хлорсульфоновой кислотой
|
|
|
|
Хлорсульфоновая кислота— активный сульфирующий реагент. При ее диссоциации образуется высокая концентрация SO3, а также HSO3+, которая является более активной электрофильной частицей, чем сульфотриоксид.
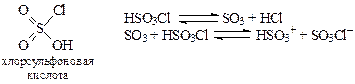
Однако,
· хлорсульфоновая кислота является опасным реагентом. Она бурно реагирует с водой, образуя H2SO4 и HCl с выделением огромного количества тепла. Несоблюдение правил работы с хлорсульфоновой кислоты может привести к взрывам, выбросам реакционной массы. Из-за опасности технологии, этот метод редко используется в промышленных синтезах;
· при избытке хлорсульфоновой кислоты арены образуют сульфохлориды, а не сульфокислоты, а при мольном соотношении реагентов сульфирование аренов в среде хлорсульфоновой кислоты осуществить технологически трудно, так как образуется вязкая малоподвижная гетерогенная масса (как и в случае жидкого SO3) и выделяется газообразный HCl:
ArH + HSO3Cl®ArSO3H + HCl
Поэтому сульфирование хлорсульфоновой кислотой предпочитают проводить в среде растворителя.
Сульфирование хлорсульфоновой кислотой в инертных растворителях (полигалогеналканы, эфиры, нитробензол и др.) используют как для С-сульфирования (например, сульфирование 2-нафтола), так и для сульфатирования. Метод не требует избытка реагента, идет с высоким выходом и высокой селективностью.
Сульфирование аренов хлорсульфоновой кислотой в полигалогеналканах и нитробензоле идет за счет SO3 по пиросульфатной схеме, а в среде эфира и подобных ему растворителей — электрофилом является комплекс SO3·L, диссоциация которого подавлена огромным избытком лиганда.
Примером О-сульфирования (сульфатирования) хлорсульфоновой кислотой в среде сухого этилового эфира может служить промышленный синтез децилата (тромбовара —препарата для лечения варикозного расширения вен):

Реакцию ведут при 10—15 °С, прибавляя раствор хлорсульфоновой кислоты в эфире (т. е. практически комплекс SO3·эфир) к эфирному раствору тетрадеканола. Содержание влаги в эфире не должно превышать 0,5 %.
Многочисленные попытки провести сульфирование иным, более технологичным способом (например, раствором SO3 в жидком SO2) не привели к получению продукта фармакопейного качества.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 948; Нарушение авторских прав?; Мы поможем в написании вашей работы!