
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система химических элементов Д.И. Менделеева
|
|
|
|
Лекция № 3. Принципы описания электронной оболочки многоэлектронного атома.
Как уже отмечалось, строгое решение уравнения Шредингера возможно только для одноэлектронных частиц. По этой причине для описания электронных оболочек многоэлектронных атомов приходится прибегать к ряду упрощений и приближений, на которых мы и остановимся.
1. Принцип водородоподобного атома. Согласно этому принципу, электронную оболочку многоэлектронного атома можно описать набором орбиталей, а соответственно и квантовых чисел атома водорода.
2. Принцип минимальной энергии - электроны заполняют орбитали в порядке увеличения их энергии. Последовательность увеличения энергии электронных орбиталей регламентируется правилами Клечковского:
Ø Энергия орбиталей возрастает в порядке увеличения суммы главного и орбитального квантовых чисел (n + l).
Ø При равных значениях (n + l) энергия орбиталей увеличивается с увеличением главного квантового числа.
Рассчитаем суммы (n + l) для орбиталей первых четырех энергетических уровней и определим порядок возрастания их энергии:
| Уровень | Орбиталь | n | l | n + l |
| 1s | ||||
| 2s | ||||
| 2p | ||||
| 3s | ||||
| 3p | ||||
| 3d | ||||
| 4s | ||||
| 4p | ||||
| 4d | ||||
| 4f | ||||
| 5s | ||||
| 5p | ||||
| 5d | ||||
| 5f |
Согласно правилам Клечковского энергия орбиталей будет увеличиваться в следующем ряду:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d...
Соответственно, энергетическая диаграмма электронных орбиталей имеет следующий вид:
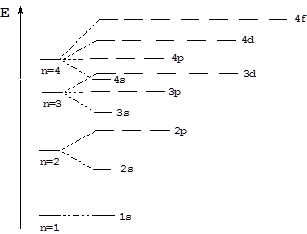
3. Принцип запрета Паули - невозможно существование двух электронов с одинаковым набором квантовых чисел. Отсюда следует, что электроны, расположенные на одной орбитали, могут различаться только значением магнитного спинового квантового числа, поскольку n, l и ml являются характеристикой орбитали и автоматически передаются ее электронам, а спиновое квантовое число электрона фиксировано (s = 1/2). Поскольку спиновое магнитное квантовое число электрона принимает два значения (mS = ±1/2), на одной орбитали могут одновременно находиться только два электрона с разной ориентацией спина.
Ограниченная емкость орбитали влечет за собой ограниченную емкость энергетических подуровней и уровней:
s-подуровень вмещает 2 электрона; p-подуровень - 6 электронов;
d-подуровень - 10 электронов; f-подуровень - 14 электронов.
Первый уровень (K-слой) вмещает 2 электрона; второй уровень (L-слой) - 8 электронов;
третий уровень (M-слой) - 18 электронов; четвертый уровень (N-слой) - 32 электрона.
4. Правило Гунда - при заполнении энергетического подуровня электроны стремятся занять максимальное число орбиталей, ориентируя спин параллельно. Например, при реализации конфигурации p3 электроны занимают орбитали следующим образом:

Исходя из рассмотренных принципов, рассмотрим строение электронных оболочек атомов элементов периодической системы Д.И. Менделеева.
Первый периодпредставлен двумя элементами - водородом и гелием, у которых заполняется первый энергетический уровень.
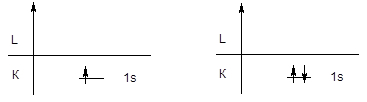
H 1s1 He 1s2
При составлении электронной формулы атома или другой атомной частицы числом указывается главное квантовое число, буквой - орбитальное квантовое число и верхним индексом - число электронов на подуровне.
Поскольку емкость первого уровня ограничена двумя электронами, следующий элемент - литий начинаетвторой период, у элементов которого происходит последовательное заполнение второго энергетического уровня, начиная с конфигурации 1s22s1 (Li) и заканчивая конфигурацией 1s22s22p6 (Ne).
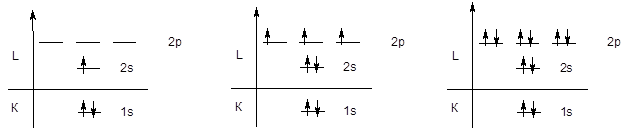
Li 1s22s1 ...... N 1s22s22p3 ....... Ne 1s22s22p6
Аналогичным образом происходит заполнение s и p-подуровней третьего энергетического уровня у элементов третьего периода (начиная с натрия и заканчивая аргоном).
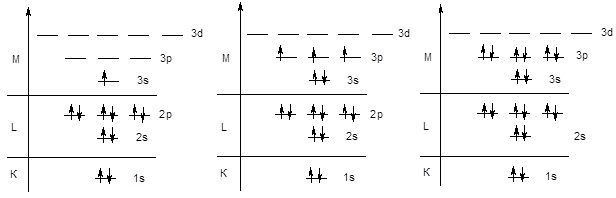 Na KL3s1 ...... P KL3s23p3 ...... Ar KL3s23p6
Na KL3s1 ...... P KL3s23p3 ...... Ar KL3s23p6
Далее следовало бы ожидать заполнения орбиталей 3d-подуровня. Однако у элементов четвертого периода начинается заполнение четвертого уровня, поскольку энергия 4s-подуровня ниже, чем энергия 3d-орбиталей - K (KLM4s1); Ca (KLM4s2). После заполнения 4s-орбитали, в соответствии с правилами Клечковского, начинается заполнение 3d-подуровня. Поскольку d-подуровень вмещает 10 электронов, этот процесс охватывает 10 элементов (от скандия до цинка). Следует обратить внимание на то обстоятельство, что в электронной формуле указывается не порядок заполнения подуровней, а их конфигурация. Поэтому подуровень 3d записывается перед подуровнем 4s, хотя последний заполняется раньше.
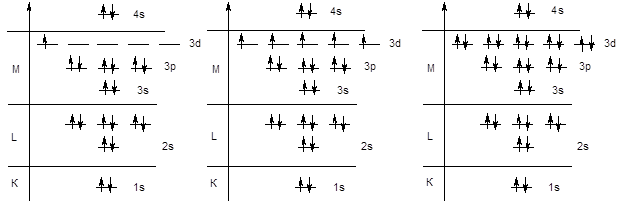 Sc KL3s23p63d14s2 Mn KL3s23p63d54s2 Zn KL3s23p63d104s2
Sc KL3s23p63d14s2 Mn KL3s23p63d54s2 Zn KL3s23p63d104s2
Аналогичным образом происходит заполнение орбиталей атомов элементов пятого периода. У элементов шестого периода после заполнения подуровня 6s начинается заполнение 5d-орбиталей (La KLM 4s24p64d105s25p66s25d1) вместо ожидаемого заполнения подуровня 4f (нарушение правил Клечковского). Тем не менее, у последующих за лантаном элементов (лантаноидов), происходит закономерное заполнение 4f-орбиталей от 4f2 у церия до 4f14 у иттербия.
Следует отметить, что в ряде мест периодической системы наблюдается нарушение ожидаемого порядка заполнения атомных орбиталей. Например, атом меди имеет электронную конфигурацию KL3s23p63d104s1 вместо ожидаемой KL3s23p63d94s2. Эта и аналогичные ей аномалии связаны со стремлением атома приобрести полностью (d10) или наполовину (d5) завершенный энергетический подуровень, обладающий повышенной устойчивостью. При этом электрон внешнего энергетического уровня как бы проваливается на предыдущий подуровень, что и обусловило название явления - провал электрона.

3d94s2 3d104s1
Рассмотрение электронных структур атомов позволяет установить физическую сущность Периодического закона Д.И. Менделеева, согласно которому свойства химических элементов и их соединений находятся в периодической зависимости от заряда ядер их атомов. Причиной периодичности изменения свойств химических элементов является периодическое повторение конфигурации внешнего электронного уровня. В свою очередь, периодическое повторение электронной конфигурации внешнего уровня вызвано конечной емкостью энергетических уровней и подуровней.
Элементы периодической системы объединены в периоды. Период - это совокупность элементов, имеющих одинаковое квантовое число внешнего энергетического уровня и расположенных в порядке увеличения заряда ядра. Период образован элементами, у которых заполняется электронами один и тот же уровень. Поскольку емкость уровней разная, то и периоды имеют разную длину - первый период содержит 2 элемента, второй и третий - 8, четвертый и пятый - 18, шестой - 32, седьмой период незавершен.
Общность электронной формулы внешнего энергетического уровня обуславливает общность химических свойств, что позволяет поместить элементы в одну группу периодической системы. Например, электронные формулы атомов щелочных металлов: Li 1s22s1, Na 1s22s22p63s1, K 1s22s22p63s23p64s1 могут быть переданы общей электронной формулой - ns1. Следует отметить, что при одинаковых конфигурациях внешнего электронного уровня щелочные металлы имеют близкие, но не одинаковые свойства, поскольку общая формула повторяется на более высоких энергетических уровнях.
Элементы, атомы которых имеют одинаковую конфигурацию внешнего уровня, называются электронными аналогами. Соответственно, выделяют s1 и s2-аналоги (s-элементы), группы p-элементов (от p1 от p6), d-элементы (от d1 до d10) и, наконец, f-элементы (от f1 до f14). В длинном варианте периодической системы группы сформированы по принципу электронной аналогии, в полудлинном варианте - семейство f-элементов рассматривается отдельно и вынесено в низ таблицы. В коротком варианте периодической системы семейство d-элементов объединено с s- и p-элементами, образуя две подгруппы одной группы: s- и p-элементы образуют главные подгруппы (подгруппы А), а d-элементы формируют побочные подгруппы (подгруппы В). Поскольку d-семейство включает 10 элементов, побочная подгруппа восьмой группы содержит 12 элементов, считая трансурановые, остальные побочные подгруппы включают по 4 элемента.
Элементы, входящие в главные и побочные подгруппы, сильно отличаются по химическим свойствам. Тем не менее, для соединений в высших степенях окисления наблюдается отчетливая аналогия в химических свойствах даже столь разных элементов. Например, элементы VIIA и VIIB-подгрупп (галогены и подгруппа марганца) в виде простых веществ разительно отличаются по физическим и химическим свойствам. Однако в высшей степени окисления хлор и марганец образуют близкие по свойствам кислотные оксиды Cl2O7 и Mn2O7, а также соответствующие им сильные кислоты и их соли - HClO4 (HMnO4), KClO4 (KMnO4). Элементы одной группы (кроме восьмой) имеют одинаковое число валентных электронов, но у элементов главной подгруппы это s- и p-электроны внешнего слоя, а у элементов побочной подгруппы валентными являются s-электроны внешнего и d-электроны предвнешнего слоя. Например:
Cl - 1s22s22p6 3s23p 5, Mn - 1s22s23s23p6 3d54s2.
Рассмотрим закономерности изменения некоторых свойств элементов, обуславливающих химическое поведение веществ: энергии ионизации, сродства к электрону и электроотрицательности.
Энергия ионизации (I) - энергия, необходимая для отрыва электрона от атома, находящегося в основном (невозбужденном) состоянии:
Э + I = Э+ + е-
Измеряется в Эв/атом или кДж/моль. В пределах одного периода для типических элементов (элементов главных подгрупп) энергия ионизации имеет ярко выраженную тенденцию к увеличению. Это обусловлено как ростом заряда ядра, так и степенью завершенности энергетических подуровней.
| Элемент | Li | Be | B | C | N | O | F | Ne |
| I, эВ/атом | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,62 | 17,42 | 21,57 |
Отклонение от общей зависимости энергии ионизации атомов бериллия и азота обусловлено повышенной устойчивостью полностью завершенного (2s2) и завершенного наполовину (2p3) энергетического подуровня. Немонотонность изменения какого-либо свойства элементов в периоде называется внутренней периодичностью.
В пределах главных подгрупп с увеличением порядкового номера элемента энергия ионизации уменьшается, что связано с увеличением радиуса атома.
Сродство к электрону (F) - энергетический эффект процесса присоединения одного электрона к нейтральному атому:
Э + е- = Э- + F
Наибольшим сродством к электрону обладают p-элементы VII-подгруппы (галогены), наименьшее и даже отрицательное значение F (в этом случае необходимо затратить энергию для того, чтобы присоединить электрон) имеют атомы с устойчивой электронной конфигурацией s2 (Be, Mg) и s2p6 (Ne, Ar, Kr), а также атомы с наполовину заполненными p-подуровнями (N, P, As):
| Элемент | Li | Be | B | C | N | O | F | Ne |
| F, В/атом | 0,59 | -0,19 | 0,30 | 1,27 | -0,21 | 1,467 | 3,45 | -0,22 |
Электроотрицательность (c) - количественная мера способности атома к оттягиванию электронов при образовании химических связей. Электроотрицательность является величиной условной и не поддается строгому экспериментальному определению. В настоящее время существует около 20 шкал электроотрицательности. Чаще всего используется относительная шкала электроотрицательности элементов, предложенная Л. Полингом.
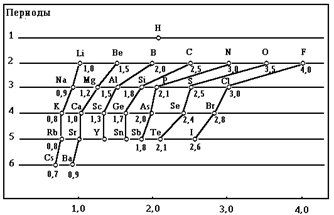
Электроотрицательность (c)
Как видно из рисунка, для типических элементов в периодах наблюдается монотонное увеличение электроотрицательности. В то же время в пределах группы с увеличением порядкового номера наблюдается немонотонность изменения электроотрицательности (вторичная периодичность). Причиной проявления вторичной периодичности является немонотонность увеличения радиуса атома с увеличением числа электронных оболочек. Появление у предыдущих элементов подгруппы заполненных d- или f-орбиталей, расположенных близко к ядру, приводит к сжатию электронной оболочки. Наиболее сильно проявляется лантаноидное или f-сжатие (контракция).
По химическим свойствам все элементы можно, в некоторой мере условно, разделить на металлы и неметаллы. Металлические свойства определяются способностью атомов отдавать электроны, то есть проявлять восстановительные свойства. К самым активным металлам относятся элементы с низкой энергией ионизации и электроотрицательностью, с большими атомными радиусами и малым числом внешних электронов (например, щелочные металлы). Неметаллы, наоборот, склонны принимать электроны, проявляя окислительную способность (галогены, кислород, сера).
Изменение свойств элементов прослеживается в периодической системе по двум направлениям. С увеличением порядкового номера элемента в пределах периода нарастают неметаллические свойства. В пределах группы для s- и p-элементов нарастают металлические свойства. Поэтому в левом нижнем углу периодической системы располагаются наиболее типичные металлы, а в правом верхнем углу - типичные неметаллы. Элементы, расположенные возле диагонали "бериллий - астат", образуют простые вещества, обладающие полупроводниковыми свойствами (германий, мышьяк, теллур).
Литература: [1] с. 81 - 98; [2] с. 60 - 103; [3] с. 30 - 46
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 969; Нарушение авторских прав?; Мы поможем в написании вашей работы!