
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия химии, законы стехиометрии. для студентов нехимических
|
|
|
|
Лекция № 1. Предмет химии. Современное атомно-молекулярное учение.
Симферополь - 2004
НЕОРГАНИЧЕСКОЙ ХИМИИ
ЛЕКЦИИ ПО ОБЩЕЙ И
В.Ф. ШУЛЬГИН, Н.С. ПЕВЗНЕР
Им. В.И. ВЕРНАДСКОГО
учебное пособие
для студентов нехимических специальностей
Учебное пособие издается по решению научно-методического совета
Таврического национального университета им. В.И. Вернадского от 21.01.04 г.
Рекомендовано методической комиссией химического факультета Таврического
национального университета им. В.И. Вернадского
Рецензент: почетный профессор Э.А.Гюннер (Таврический национальный университет
им. В.И. Вернадского)
В.Ф. Шульгин, Н.С. Певзнер. Лекции по общей и неорганической химии / Учебное пособие для студентов нехимических специальностей. Симферополь: Таврический национальный университет им. В.И. Вернадского, 2004. - 127 с.; ил.
В учебном пособии кратко освещены основные вопросы программы по общей и неорганической химии для студентов нехимических специальностей Таврического национального университета (биология, география, экология). Материал, изложенный в книге, может быть использован студентами вузов другого профиля, например, сельскохозяйственного или медицинского, а также студентами химических специальностей.
© В.Ф. Шульгин, Н.С. Певзнер, 2004
Химия - это наука, изучающая состав, строение и свойства химических веществ, а также закономерности их взаимных превращений.
Особенностью окружающего нас мира является материальность его объектов том смысле, что они существуют вне и независимо от нашего сознания. Все известные к настоящему времени проявления материи можно свести к двум ее видам - веществу и полю. Вещество - это форма материи, носители которой имеют ненулевую массу покоя. Примерами таких носителей могут служить протон, нейтрон и электрон - элементарные частицы, из которых построены атомы. Носители свойств поля (например, фотоны) характеризуются нулевой массой покоя. Под химическим веществом подразумевают конкретный вид материи, образованный атомами химических элементов.
Особенностью материи является постоянное ее движение, под которым понимают любое изменение материального объекта. Различают несколько форм движения материи, основными из которых являются физическая, химическая и биологическая. Под химической формой движения подразумеваются превращения веществ в другие вещества, при которых сохраняются неизменными ядра атомов - носителей химических свойств материи. В основе химической формы движения лежит перестройка структуры валентных электронных оболочек атомов - явление физическое. Тем не менее, химическая форма является самостоятельным видом изменения материи и не может рассматриваться как частный случай физической формы ее движения. В свою очередь, химическая форма движения является основой биологической, поскольку в основе жизнедеятельности любого живого организма лежит сложный комплекс химических реакций.
Поскольку химия занимается изучением как химических, так физических явлений, важным является проведение границы между ними. В настоящее время критериями протекания химического процесса (химической реакции) считают:
· образование новых химических частиц;
· тепловой эффект процесса более 20-40 кДж/моль.
Тем не менее, в ряде случаев процесс не удается четко отнести к физическому или химическому. Примерами таких явлений могут служить растворение или испарение некоторых веществ. Так, процесс испарения вольфрама идет с образованием в газовой фазе двухатомных молекул W2, которые отсутствуют в кристаллическом состоянии, и сопровождается значительным по величине тепловым эффектом (770 кДж/моль). Несмотря на то, что новых химических веществ не образуется, этот процесс нельзя считать чисто физическим, в подобном случае лучше подходит термин "физико-химическое явление".
Являясь самостоятельной наукой, химия связана с другими естественными науками - физикой, биологией, геологией. Связь иногда бывает столь тесной, что на границе наук возникают новые их ветви, которые можно рассматривать как самостоятельные науки, такие, как физическая химия и биохимия, гидро- и геохимия. Широкое применение математического аппарата и вычислительной техники в современной химии привело к возникновению таких специфических наук, как математическая и компьютерная химия. В свою очередь для химии, как и для других естественных наук, характерна тенденция к дифференциации, т.е. выделению в относительно самостоятельные науки ее отдельных частей. Современная химия представляет собой комплекс наук, включающий общую и неорганическую химию, аналитическую химию, органическую химию, химию элементоорганических соединений, физическую и коллоидную химию, бионеорганическую и биоорганическую химию, квантовую и компьютерную химию, радиохимию, плазмохимию, криохимию и т.д.
Основу современной общей химии составляет ряд концепций, главными из которых являются:
· химическая атомистика (атомно-молекулярное учение);
· учение о строении вещества (теория строения атома и химической связи);
· учение о химическом процессе (химическая кинетика и химическая термодинамика);
· теория растворов и дисперсных систем.
Современную атомно-молекулярную теорию можно изложить в виде ряда положений:
1. Химические вещества имеют дискретное (прерывистое) строение. Частицы вещества находятся в постоянном хаотическом тепловом движении.
2. Основной структурной единицей химического вещества является атом.
3. Атомы в химическом веществе связаны друг с другом, образуя молекулярные частицы или атомные агрегаты (надмолекулярные структуры).
4. Сложные вещества (или химические соединения) состоят из атомов разных элементов. Вещества простые состоят из атомов одного элемента и должны рассматриваться как гомоядерные химические соединения.
При формулировании основных положений атомно-молекулярной теории нам пришлось ввести несколько понятий, на которых необходимо остановиться более подробно, поскольку они являются основными в современной химии. Это понятия "атом" и "молекула", точнее атомные и молекулярные частицы.
Атомные частицы включают в себя собственно атом, атомные ионы, атомные радикалы и атомные ион-радикалы.
Атом - это наименьшая электронейтральная частица химического элемента, являющаяся носителем его химических свойств, и состоящая из положительно заряженного ядра и электронной оболочки.
Атомный ион - это атомная частица, обладающая электростатическим зарядом, но не имеющая неспаренных электронов, например, Cl- - хлорид-анион, Na+ - катион натрия.
Атомный радикал - электронейтральная атомная частица, содержащая неспаренные электроны. Например, атом водорода фактически представляет собой атомный радикал - Н ×.
Атомная частица, имеющая электростатический заряд и неспаренные электроны, называется атомным ион-радикалом. Примером такой частицы может служить катион Mn2+, содержащий пять неспаренных электронов на d-подуровне (3d5).
Одной из важнейших физических характеристик атома является его масса. Поскольку абсолютное значение массы атома ничтожно мало (масса атома водорода равна 1,67×10-27 кг), в химии используется относительная шкала масс, в которой за единицу выбрана 1/12 часть массы атома углерода изотопа-12. Относительная атомная масса - это отношение массы атома к 1/12 массы атома углерода изотопа 12С.
Следует отметить, что в периодической системе Д.И. Менделеева приведены среднеизотопические атомные массы элементов, которые в большинстве своем представлены несколькими изотопами, вносящими свой вклад в атомную массу элемента пропорционально своему содержанию в природе. Так, элемент хлор представлен двумя изотопами - 35Cl (75 мол.%) и 37Cl (25 мол.%). Среднеизотопическая масса элемента хлор составляет 35,453 а.е.м. (атомных единиц массы) (35×0,75 + 37×0,25).
Аналогично атомным частицам, молекулярные частицы включают в себя собственно молекулы, молекулярные ионы, молекулярные радикалы и ион-радикалы.
Молекула - это наименьшая устойчивая совокупность взаимосвязанных атомных частиц, являющаяся носителем химических свойств вещества. Молекула лишена электростатического заряда и не имеет неспаренных электронов.
Молекулярный ион - это молекулярная частица, обладающая электростатическим зарядом, но не имеющая неспаренных электронов, например, NO3- - нитрат-анион, NH4+ - катион аммония.
Молекулярный радикал - электронейтральная молекулярная частица, содержащая неспаренные электроны, например, метильный радикал - × СН3. В обычных условиях радикалы представляют собой реакционно-способные частицы с небольшим временем жизни (порядка 10-3 с).
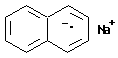
Молекулярная частица, имеющая электростатический заряд и неспаренные электроны, называется молекулярным ион-радикалом. Примером такой частицы может служить анион-радикал, образующийся при растворении металлического натрия в бензольном растворе нафталина:
Важной характеристикой молекулы является ее относительная молекулярная масса. Относительная молекулярная масса (Мr) - это отношение среднеизотопической массы молекулы, вычисленной с учетом естественного природного содержания изотопов, к 1/12 массы атома углерода изотопа 12C.
Таким образом, мы выяснили, что мельчайшей структурной единицей любого химического вещества является атом, точнее атомная частица. В свою очередь в любом веществе, исключая инертные газы, атомы связаны друг с другом химическими связями. При этом возможно образование двух типов веществ: молекулярных соединений, у которых можно выделить мельчайшие носители химических свойств, обладающие устойчивой структурой, и соединений надмолекулярной структуры, которые представляют собой атомные агрегаты, в которых атомные частицы связаны ковалентной, ионной или металлической связью. Соответственно, эти вещества представляют собой атомные, ионные или металлические кристаллы. В свою очередь, молекулярные вещества образуют молекулярные или молекулярно-ионные кристаллы. Фактически, работая с конкретным химическим веществом, мы имеем дело не с отдельными атомами или молекулами, а с совокупностью очень большого числа частиц, уровни организации которых можно отобразить следующей схемой:

Для количественного описания больших массивов частиц, которыми являются макротела, было введено специальное понятие "количество вещества", как строго определенное число его структурных элементов. Единицей количества вещества является моль. Моль - это количество вещества (n), содержащее столько структурных или формульных единиц, сколько атомов содержится в 12 г углерода изотопа 12С. В настоящее время это число довольно точно измерено и составляет 6,022×1023 (число Авогадро, NA). В качестве структурных единиц могут выступать атомы, молекулы, ионы, химические связи и другие объекты микромира. Понятие "формульная единица" используется для веществ с надмолекулярной структурой и определяется как простейшее соотношение между составляющими его элементами (брутто-формула). В данном случае формульная единица берет на себя роль молекулы. Например, 1 моль хлорида кальция содержит 6,022×1023 формульных единиц - CaCl2.
Одной из важных характеристик вещества является его молярная масса (М, кг/кмоль, г/моль). Молярная масса - это масса одного моля вещества. Относительная молекулярная масса и молярная масса вещества численно совпадают, но имеют разную размерность, например, для воды Мr = 18 (относительная атомная и молекулярная массы величины безразмерные), М = 18 г/моль. Количество вещества и молярная масса связаны простым соотношением:

Большую роль в формировании химической атомистики сыграли основные стехиометрические законы, которые были сформулированы на рубеже XVII и XVIII столетий.
1. Закон сохранения массы (М.В. Ломоносов,1748).
Сумма масс продуктов реакции равна сумме масс исходных веществ. В качестве дополнения к этому закону может служить закон сохранения массы элемента (1789, А.Л. Лавуазье) - масса химического элемента в результате реакции не изменяется. Эти законы имеют для современной химии определяющее значение, поскольку позволяют моделировать химические реакции уравнениями и выполнять на их основе количественные вычисления.
2. Закон постоянства состава (Ж. Пруст,1799-1804).
Индивидуальное химическое вещество молекулярного строения имеет постоянный качественный и количественный состав, не зависящий от способа его получения. Соединения, подчиняющиеся закону постоянства состава, называют дальтонидами. Дальтонидами являются все известные к настоящему времени органические соединения (около 30 миллионов) и часть (около 100 тыс.) неорганических веществ. Вещества, имеющие немолекулярное строение (бертолиды), не подчиняются данному закону и могут иметь переменный состав, зависящий от способа получения образца. К ним относятся большинство (около 500 тыс.) неорганических веществ. В основном это бинарные соединения d-элементов (оксиды, сульфиды, нитриды, карбиды и т.д.). Примером соединения переменного состава может служить оксид титана(III), состав которого варьирует в пределах от TiO1,46 до TiO1,56. Причиной переменного состава и иррациональности формул бертолидов являются изменения состава части элементарных ячеек кристалла (дефекты кристаллической структуры), не влекущие за собой резкого изменения свойств вещества. Для дальтонидов подобное явление невозможно, поскольку изменение состава молекулы ведет к образованию нового химического соединения.
3. Закон эквивалентов (И. Рихтер, Дж. Дальтон, 1792-1804).
Массы реагирующих веществ прямо пропорциональны их эквивалентным массам.
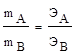 ,
,
где ЭА и ЭВ - эквивалентные массы реагирующих веществ.
Эквивалентной массой вещества называется молярная масса его эквивалента.
Эквивалент - это реальная или условная частица, отдающая или присоединяющая один катион водорода в реакциях кислотно-основного взаимодействия, один электрон в окислительно-восстановительных реакциях или взаимодействующая с одним эквивалентом любого другого вещества в реакциях обмена. Например, при взаимодействии металлического цинка с кислотой один атом цинка вытесняет два атома водорода, отдавая при этом два электрона:
Zn + 2H+ = Zn2+ + H2
Zn0 - 2e- = Zn2+
Следовательно, эквивалентом цинка является 1/2 его атома, т.е. 1/2 Zn (условная частица).
Число, показывающее, какая часть молекулы или формульной единицы вещества является его эквивалентом, называется фактором эквивалентности - fэ. Эквивалентная масса, или молярная масса эквивалента, определяется как произведение фактора эквивалентности на молярную массу:
Э = М·fэ
Например, в реакции нейтрализации серная кислота отдает два катиона водорода:
H2SO4 + 2KOH = K2SO4 + 2H2O
Соответственно, эквивалентом серной кислоты является 1/2 H2SO4, фактор эквивалентности равен 1/2, а эквивалентная масса составляет (1/2)×98 = 49 г/моль. Гидроксид калия связывает один катион водорода, поэтому его эквивалентом является формульная единица, фактор эквивалентности равен единице, а эквивалентная масса равна молярной массе, т.е. 56 г/моль.
Из рассмотренных примеров видно, что при расчете эквивалентной массы необходимо определить фактор эквивалентности. Для этого существует ряд правил:
1. Фактор эквивалентности кислоты равен 1/n, где n - число отданных в реакции катионов водорода.
2. Фактор эквивалентности основания равен 1/n, где n - число отданных в реакции гидроксид-анионов.
3. Фактор эквивалентности соли равен частному от деления единицы на произведение валентности (v) катиона металла или кислотного остатка и их числа (n) в составе соли (стехиометрический индекс в формуле):
fэ = 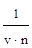
Например, для Al2(SO4)3 - fэ = 1/6
4. Фактор эквивалентности окислителя (восстановителя) равен частному от деления единицы на число присоединенных (отданных) им электронов.
Следует обратить внимание на то обстоятельство, что одно и то же соединение может иметь разный фактор эквивалентности в разных реакциях. Например, в реакциях кислотно-основного взаимодействия:
H3PO4 + KOH = KH2PO4 + H2O; fэ(H3PO4) = 1
H3PO4 + 2KOH = K2HPO4 + 2H2O; fэ(H3PO4) = 1/2
H3PO4 + 3KOH = K3PO4 + 3H2O; fэ(H3PO4) = 1/3
или в окислительно-восстановительных реакциях:
KMn7+O4 + NaNO2 + H2SO4 ® Mn2+SO4 + NaNO3 + K2SO4 + H2O
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O fэ(KMnO4) = 1/5
KMn7+O4 + NaNO2 + H2O ® Mn4+O2 + NaNO3 + KOH
MnO4- + 2H2O + 3e- ® MnO2 + 4OH- fэ(KMnO4) = 1/3
4. Закон Авогадро (А. Авогадро,1811).
В равных объемах разных газов, измеренных в одинаковых условиях (давление, температура), содержится одинаковое число молекул.
Из закона следует, что:
Ø При нормальных условиях (н.у., Т = 273 К, р = 101,325 кПа) один моль любого газа занимает одинаковый объем - молярный объем (Vm), равный 22,4 л/моль.

Ø Отношение масс равных объемов разных газов, измеренных в одинаковых условиях (относительная плотность газа по газу), равна отношению их молекулярных (молярных) масс.

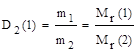
Чаще всего определяют относительную плотность по водороду или воздуху. Соответственно,
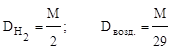 ,
,
где 29 - средняя, точнее средневзвешенная, молекулярная масса воздуха.
Ø Объемы реагирующих газов относятся друг к другу и к объемам газообразных продуктов реакции как простые целые числа (закон объемных отношений Гей-Люссака).
Литература: [1] c. 11 - 45; [2] с. 4 - 42
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1817; Нарушение авторских прав?; Мы поможем в написании вашей работы!