
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 11. Теории кислот и оснований
|
|
|
|
Существует несколько теорий кислот и оснований. Одна из первых нашла свое отражение в теории электролитической диссоциации, с точки зрения которой кислота - это электролит, отщепляющий при диссоциации в качестве катиона только катион водорода. Например,
HCl = H+ + Cl-
Реальный процесс значительно сложнее, и представляет собой взаимодействие растворенного вещества с водой с образованием катиона гидроксония:
HCl + H2O = H3O+ + Cl-
Слабые кислоты диссоциируют обратимо и в их растворах устанавливается равновесие, которое характеризуется соответствующей константой - константой кислотной диссоциации, Ka.
CH3COOH  CH3COO- + H+
CH3COO- + H+

Процесс диссоциации слабых многоосновных кислот происходит ступенчато, причем каждая ступень характеризуется своей константой, например:
H3PO4  H+ + H2PO4-;
H+ + H2PO4-; 
H2PO4-  H+ + HPO42-;
H+ + HPO42-; 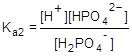
HPO42-  H+ + PO43-;
H+ + PO43-; 
Суммирование уравнений ступенчатой диссоциации дает общее уравнение диссоциации кислоты. Соответственно произведение ступенчатых констант дает общую константу электролитической диссоциации.
H3PO4  3H+ + PO43-;
3H+ + PO43-;  = К1×К2×К3
= К1×К2×К3
Присутствие в растворах кислот катиона гидроксония обуславливает их общие физические свойства, из которых важнейшим является окрашивание индикаторов в соответствующие цвета: лакмуса в красный, метилового оранжевого в розовый. Фенолфталеин в кислых растворах бесцветен. Важнейшими химическими свойствами кислот являются растворение металлов, стоящих в ряду стандартных электродных потенциалов левее водорода, и взаимодействие с основаниями с образованием солей и воды (реакция нейтрализации).
nH+ + M = Mn+ + n/2H2;
H3O+ + OH- = 2H2O
Основание в рамках теории электролитической диссоциации - это электролит, отщепляющий при диссоциации в качестве аниона только гидроксид-анион. Например,
NaOH = Na+ + OH-
Очевидно, что процесс диссоциации слабых оснований обратим и характеризуется соответствующей константой равновесия - константой основной диссоциации, Kb.
Mg(OH)2  Mg(OH)+ + OH-
Mg(OH)+ + OH-

Общие физические и химические свойства растворов оснований вызваны присутствием в них гидроксид-анионов. Растворы оснований придают характерную окраску кислотно-основным индикаторам: лакмусу - синюю, метиловому оранжевому - желтую, фенолфталеину - малиновую.
Теория электролитической диссоциации удовлетворительно объясняет реакции кислотно-основного взаимодействия в водных растворах, но не пригодна для описания реакций данного типа, протекающих в неводных растворителях или в газах. Примером такой реакции может служить взаимодействие газообразных аммиака и хлороводорода.
NH3 + HCl = NH4Cl
Продуктом реакции является соль - хлорид аммония, следовательно реакция является кислотно-основной. Свое объяснение она находит в рамках современных теорий кислот и оснований: протолитической теории Брёнстеда-Лоури и электронной теории Льюиса.
Согласно протолитической теории Брёнстеда-Лоури, кислота - это соединение, являющееся донором катиона водорода (протона). Основание - это акцептор протона. С точки зрения этой теории взаимодействие аммиака с хлороводором трактуется как кислотно-основное:

кислота основание
Процесс присоединения протона к молекуле аммиака электронная теория Льюиса рассматривает более широко, как донорно-акцепторное взаимодействие. В рамках данной теории кислота - это акцептор неподеленной электронной пары, а основание - это донор неподеленной электронной пары.

кислота Льюиса основание Льюиса
Теория Льюиса позволяет трактовать как кислотно-основные и те реакции, которые не сопровождаются переносом протона, например,
H3N: + BF3 = H3N:®BF3
кислота Льюиса основание Льюиса
Fe3+ + 6:CN- = [Fe(CN)6]3-
кислота Льюиса основание Льюиса
Для описания кислотно-основных реакций в неводных растворителях обычно используется теория сольвосистем, которая рассматривает взаимодействие относительно процесса собственной диссоциации растворителя. Кислотой является вещество, растворение которого увеличивает концентрацию положительных ионов растворителя. Основанием является вещество, растворение которого приводит к увеличению концентрации отрицательных ионов растворителя. Если рассмотреть уравнение собственной диссоциации воды
H2O + H2O  H3O+ + OH-,
H3O+ + OH-,
то можно увидеть, что теория сольвосистем включает теорию Аррениуса как частный случай. Кроме этого она позволяет рассматривать кислотно-основные реакции в неводных растворителях. В качестве примера такого растворителя рассмотрим жидкий аммиак, который подвергается автоионизации по следующей схеме:
NH3 + NH3  NH4+ + NH2-
NH4+ + NH2-
Вещества, растворяющиеся в аммиаке с отщеплением катиона аммония, будут вести себя в нем как кислоты. Вещества, растворение которых в жидком аммиаке ведет к увеличению концентрации амид-анионов, будут вести себя как основания.
NH4Cl = NH4+ + Cl-; NaNH2 = Na+ + NH2-
кислота основание
Для данной пары кислота - основание можно составить уравнение реакции нейтрализации:
NH4Cl + NaNH2 = NaCl + 2NH3
кислота основание соль растворитель
Этот пример наглядно показывает, что кислотно-основные свойства вещества зависят от растворителя. Так, хлорид аммония, который в воде является солью, в жидком аммиаке будет вести себя как кислота.
Литература: [1] с. 234 - 237; [2] с. 309 - 313; [3] с. 131 - 132
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1816; Нарушение авторских прав?; Мы поможем в написании вашей работы!