
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 17. Координационные соединения
|
|
|
|
Координационными называются соединения, содержащие в своем составе молекулярные частицы, имеющие центр координации и состоящие из частиц, способных к самостоятельному существованию. Основы теории строения координационных соединений были заложены в 1893 году швейцарским ученым А. Вернером. Современную координационную теорию можно сформулировать в виде ряда положений:
1. Координационное соединение имеет центральный атом, вокруг которого расположены остальные атомы или атомные группировки. Это явление называется координацией. Чаще всего в роли центрального атома (иона) выступает катион металла.
2. Атомные или молекулярные частицы, непосредственно связанные с центральным атомом, называются лигандами. Связь центрального атома с лигандами обычно реализуется за счет ковалентного взаимодействия. Совокупность центрального атома и лигандов образует внутреннюю (координационную) сферу.
3. Атомы и группы атомов, непосредственно не связанные с центральным атомом, образуют внешнюю сферу. Связь между внешней и внутренней сферой осуществляется за счет сил невалентного взаимодействия (электростатическое взаимодействие, водородные связи).
Рассмотрим данные положения на примере одного из первых координационных соединений, полученных в лаборатории - соли Тассера, CoCl3×6NH3. Центральное место в данном соединении занимает катион кобальта(III), окруженный шестью молекулами аммиака, которые выполняют роль лигандов и связаны с центральным атомом ковалентными связями, образованными по донорно-акцепторному механизму. Во внешней сфере расположены три хлорид-аниона, связанные с комплексным катионами силами электростатического притяжения.

Наряду со степенью окисления важнейшей характеристикой центрального атома является координационное число (КЧ) - число мест в координационной сфере или число s-связей, с помощью которых центральный атом связан с лигандами. Для известных в настоящее время координационных соединений КЧ варьирует в пределах от 2 до 13, хотя чаще всего принимает значения 4 и 6. Координационному числу 4 соответствует квадратная или тетраэдрическая геометрия комплексной частицы:
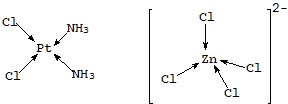
Координационному числу 6 обычно отвечает геометрия октаэдра или тетрагональной бипирамиды:
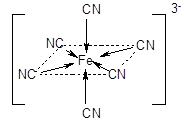
Число мест координационной сферы, занимаемых лигандом, или число s-связей, которыми он связан с центральным атомом, называется его дентатностью. Во всех рассмотренных примерах в состав внутренней сферы входят монодентатные лиганды. Лиганды, содержащие несколько донорных атомов, могут проявлять более высокую дентатность, вплоть до шести.
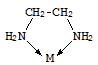
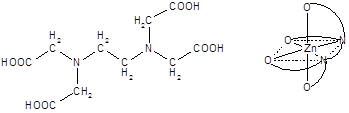
Этилендиамин в роли бидентатного Этилендиаминтетрауксусная кислота (ЭДТА, H4Y) и ее анион
лиганда (Y4-) в роли гексадентатного лиганда
В растворах координационные соединения диссоциируют в два этапа. Вначале отщепляются ионы внешней сферы, причем данный процесс обычно идет необратимо
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-,
затем идет ступенчатое обратимое отщепление лигандов:
[Fe(CN)6]3-  [Fe(CN)5]3- + CN-;
[Fe(CN)5]3- + CN-;
[Fe(CN)5]2-  [Fe(CN)4]- + CN-;
[Fe(CN)4]- + CN-;
....................................
[Fe(CN)]2+  Fe3+ + CN-
Fe3+ + CN-
Суммарно данный процесс можно описать следующим уравнением:
[Fe(CN)6]3-  Fe3+ + 6CN-
Fe3+ + 6CN-
Каждая ступень диссоциации характеризуется своей константой равновесия - ступенчатой константой нестойкости. Общей константой нестойкости характеризуется суммарный процесс диссоциации комплексной частицы:
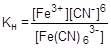 = 1×10-44
= 1×10-44
В последние годы для описания равновесия в растворах координационных соединений чаще используют константу устойчивости - константу процесса образования комплексной частицы:
Fe3+ + 6CN-  [Fe(CN)6]3-
[Fe(CN)6]3-
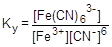 =1×1044
=1×1044
Константа устойчивости (образования) и константа нестойкости связаны простым соотношением: Ку = 1/Кн. Величины констант устойчивости или нестойкости наиболее важных комплексных молекул и ионов можно найти в справочной литературе.
При построении названия комплексной частицы вначале перечисляют анионные, затем молекулярные лиганды в алфавитном порядке, указывая их количество греческими числительными. Анионные лиганды получают окончание "о", молекулярные сохраняют свое название. Исключение сделано для воды (аква), аммиака (аммин) и некоторых других молекул. После перечисления лигандов называют центральный атом с указанием его степени окисления. При этом анионные комплексы получают окончание "ат" и обычно используется латинское название элемента-комплекообразователя. Например:
[Pt(NH3)2Cl2] - дихлородиамминплатина(II);
[Co(NH3)6]Cl3 - гексаамминкобальта(III) хлорид;
K3[Fe(CN)6] - гексацианоферрат(III) калия;
[Pt(NH3)4][PdCl4] - тетраамминплатины(II) тетрахлоропалладат(II).
Классификацию координационных соединений (КС) проводят по ряду признаков.
I. По заряду внутренней сферы координационные соединения делят на:
1. нейтральные - [Pt(NH3)2Cl2]0;
2. катионные - [Co(NH3)6]3+Cl3;
3. анионные - K3[Fe(CN)6]3-;
4. катионно-анионные - [Pt(NH3)4]2+[PdCl4]2-.
II. По природе лигандов выделяют следующие основные группы координационных соединений:
1. Аквакомплексы, содержащие в качестве лигандов молекулы воды, например, [Co(H2О)6]Cl2.
2. Аммиакаты и аминаты, содержащие в качестве лигандов аммиак и органические амины, например,[Cu(NH3)4]SO4.
3. Гидроксокомплексы, содержащие в качестве лигандов гидроксид-анионы, например, K3[Al(OH)6].
4. Ацидокомплексы, в которых в роли лигандов выступают анионы кислотных остатков, например, K4[Fe(CN)6].
5. Карбонилы, в которых роль лигандов играют молекулы оксида углерода(II), например, [Ni(CO)4] и [Fe(CO)5].
6. p-Комплексы, в которых центральный атом координирует лиганд за счет делокализованных кратных связей или ароматической системы, например:
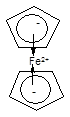
Бис(циклопентадиенил)железо(II), ферроцен
Кроме рассмотренных выше гомолигандных комплексов, содержащих одинаковые лиганды, выделяют обширную группу гетеролигандых координационных соединений, в состав которых входят лиганды разных типов. Примером соединения такого типа может служить противоопухолевый лекарственный препарат "цисплатин" - цис-изомер [Pt(NH3)2(Cl)2].
В качестве отдельной группы выделяют хелаты - координационные соединения, содержащие во внутренней сфере циклы, включающие центральный атом. Образуют хелаты полидентатные лиганды, которые координируют центральный атом несколькими донорными центрами, как бы захватывая его в клещи. Хелаты обычно отличаются прочностью, хорошей растворимостью в органических растворителях, яркой окраской и высокой биологической активностью.
Среди хелатов особое место занимают комплексы с макроциклическими лигандами - краун-эфирами, порфиринами и корринами. Краун-эфиры представляют собой циклические макроэфиры, которые образуют относительно прочные комплексы с катионами щелочных металлов, удерживая их в полости молекулы.
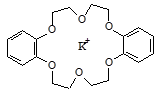
комплекс дибензо-18-краун-6 с катионом калия
Координационные соединения данного типа перспективны как реагенты для определения и извлечения катионов щелочных и щелочноземельных металлов, в том числе и их радиоактивных изотопов, а также как модели природных ионофоров (валиномицин, энниатин) - переносчиков катионов щелочных металлов через клеточные мембраны.
Комплексы катионов металлов с порфиринами лежат в основе важнейших биомолекул - гемоглобина и миоглобина (железо), гемоцианина (медь) и хлорофилла (магний).
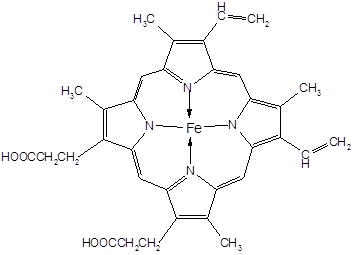
ферропротопорфирин (гем)
Сходный по строению комплекс кобальта с корриновым циклом лежит в основе витамина В12 - цианкобаламина.
Литература: [1] с. 563 - 587; [2] с. 367 - 396
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 3374; Нарушение авторских прав?; Мы поможем в написании вашей работы!