
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения водорода
|
|
|
|
Если учесть органические вещества, то следует признать, что водород - элемент, образующий наибольшее число соединений. Важнейшими неорганическими соединениями водорода являются гидриды и бинарные соединения водорода в степени окисления +1. Последние также часто называют гидридами, что не совсем корректно, ибо гидриды - это бинарные соединения водорода в степени окисления -1. "Классические гидриды" могут образовывать только те элементы, электроотрицательность у которых значительно меньше, чем у водорода. Это щелочные и щелочноземельные металлы, а также магний и бериллий. Они образуют типичные солеподобные гидриды, при электролизе расплавов которых водород выделяется на аноде:
2H- - 2e- ® H20
При взаимодействии гидридов данного типа с водой также выделяется водород:
NaH-1 + H2+1O = NaOH + H20
Элементы, электроотрицательность которых незначительно отличается от водорода, образуют ковалентные гидриды (B2H6, SiH4). Известно небольшое число комплексных гидридов, например, Li[AlH4], Na[BH4], которые широко применяются в органическом синтезе в качестве восстановителей.
Из бинарных соединений водорода в степени окисления +1 в данном разделе будет рассмотрен оксид водорода (вода) и его пероксид (перекись водорода).
Химически чистая вода представляет собой бесцветную жидкость без вкуса и запаха. Молекула воды - Н2О - имеет угловое строение. Образование молекулы воды происходит с участием sp3-гибридных орбиталей атома кислорода, две из которых заняты неподеленными электронными парами и поэтому вклада в геометрию молекулы не вносят. Перекрывание одноэлектронных облаков двух гибридных орбиталей кислорода и 1s-орбиталей двух атомов водорода приводит к образованию уголковой молекулы. Отталкивающие действие двух неподеленных пар электронов уменьшает валентный угол HOH до 104,5° (см. стр. 19).
В кристаллическом состоянии молекула воды, окруженная четырьмя соседями, образует с ними очень прочные водородные связи, вследствие чего вода обладает аномально высокой температурой кристаллизации (0 °) и кипения (100 °С). Согласно клатратной теории в жидкой воде существуют микроскопические фрагменты кристаллической структуры льда - клатраты, находящиеся в равновесии с жидкой фазой.
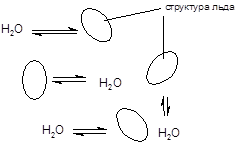
За счет образования прочных водородных связей, а также координационных соединений, вода является хорошим растворителем для многих типов органических и неорганических соединений, частицы которых существуют в растворах в виде аддуктов с молекулами воды - гидратов. При выделении из водных растворов многие вещества кристаллизуются в виде гидратов, образуя кристаллогидраты. Можно выделить три типа кристаллогидратов, отличающихся характером связывания воды:
1. Клатраты - имеющие кристаллическую структуру льда, полости которой заняты частицами вещества. Такое строение имеют кристаллогидраты солей щелочных металлов, содержащие большое количество воды, например, Na2SO4×10H2O, а также кристаллогидраты, образуемые галогенами и инертными газами - Cl2×8H2O, или Ar 6H2O.
2. Аквакомплексы, содержащие воду, координированную катионом металла, чаще всего переходного, например, CoCl2×6H2O, точнее [Co(OH2)6]Cl2.
3. Кристаллогидраты, содержащие воду, связанную с частицами вещества водородными связями. Часто этот тип связывания воды реализуется в кристаллогидратах органических веществ.
С химической точки зрения вода довольно реакционноспособное соединение, вступающее во взаимодействие с различными простыми и сложными веществами, в том числе с органическими соединениями.
Кроме оксида водорода хорошо изучен его аналог - оксид дейтерия - D2O, более известный под названием "тяжелая вода". Тяжелая вода широко применяется в атомной энергетике как замедлитель нейтронов. Реакции с участием тяжелой воды идут медленней, а температура ее кипения (101,4 °С) несколько выше по сравнению с H2O, поэтому при проведении электролиза или дистилляции большого количества воды тяжелая вода накапливается в остатке.
Пероксид водорода (перекись) - Н2О2 - бесцветная сиропообразная жидкость (d = 1,45 г/см3), неустойчивая в чистом виде, но устойчивая в водных растворах до 30% концентрации. Распад пероксида водорода катализируется соединениями тяжелых металлов, например, MnO2.
2Н2О2 = 2Н2О + О2
Получают пероксид водорода электролизом водных растворов серной кислоты или гидросульфата аммония. При этом на аноде образуется пероксосерная кислота, гидролиз которой приводит к образованию пероксида водорода:
2HSO4- - 2e- ® H2S2O8
H2S2O8 + 2H2O = 2H2SO4 + H2O2
Вследствие промежуточной степени окисления кислорода (-1), пероксид водорода, в зависимости от условий проведения реакции, может быть как окислителем, так и восстановителем. В кислой среде H2O2 довольно сильный окислитель:
H2O2 + 2H+ + 2e- ® 2H2O; E0 = 1,78 В
В то же время пероксид водорода окисляется более сильными окислителями, например, перманганатом калия:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
Водные растворы пероксида водорода (в основном 3%) применяются для отбелки тканей и меха, дезинфекции, консервации, протравливания семян. Важную роль пероксид водорода играет в процессах самоочищения природных водоемов, в которых он содержится в ничтожной концентрации (порядка 3×10-5 моль/л), но тем не менее, эффективно окисляет биологические загрязнения.
Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270
Лекция № 19. Элементы VII-A-подгрупы (галогены)
Элементы VIIA-подгруппы: фтор - F, хлор - Cl, бром - Br, иод - I (галогены)и радиоактивный астат - At. Фтор и иод представлены в природе одним изотопом - 19F и 127I, хлор и бром имеют по два природных изотопа: 35Cl (75,5%) и 37Cl (24,5%); 79Br (50,5%) и 82Br (49,5%). Радиоактивный изотоп 131I (период полураспада 8 суток) - один из наиболее опасных продуктов деления урана, поскольку накапливается в щитовидной железе. Общая электронная формула галогенов - ns2np5 - и высокая электроотрицательность обуславливает проявление в большинстве их соединений степени окисления -1. Для фтора, обладающего самой высокой электроотрицательностью (4,0 по Полингу), данная степень окисления и валентность 1 являются единственными. Хлор, бром и иод могут проявлять более высокие валентности и положительные степени окисления (в основном +1, +3, +5 и +7) за счет использования вакантных орбиталей d-подуровня, как показано на схеме для атома хлора.
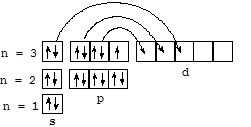
Фтор и хлор - распространенные элементы земной коры (0,03 и 0,02 мол.%, соответственно). Кларки брома и иода выражаются значительно более скромными числами (1,5×10-5 и 4×10-6 мол.%). Основные минералы фтора и хлора: CaF2 - плавиковый шпат (флюорит), Na3[AlF6] - криолит, Ca5(PO4)3F - фторапатит, NaCl - каменная соль (галит), KCl - сильвин, NaCl×KCl - сильвинит, KCl×MgCl2×6H2O - карналлит. Бром и иод самостоятельных минералов не образуют и обычно сопутствуют хлору. Иод накапливается некоторыми морскими водорослями.
Все галогены играют важную биологическую роль. Фтор входит в состав зубной эмали. Пониженное содержание фтора в питьевой воде (меньше 0,5 мг/л) способствует развитию кариеса. Однако, повышенное содержание фтора приводит к другому заболеванию зубов - флюорозу. Хлор поступает в организм человека в основном в виде поваренной соли (дневная норма составляет 4 - 8 г) и участвует в образовании желудочного сока, содержащего 0,3% хлороводорода. Иод концентрируется в основном в щитовидной железе и входит в состав тироксина - гормона щитовидной железы. Недостаточное поступление иода в организм приводит к нарушению обмена веществ, замедлению роста и ослаблению умственного развития (кретинизм), а также к развитию базедовой болезни. Содержание брома в организме среднего человека (масса тела 70 кг) составляет 260 мг, но биологическая роль данного элемента в настоящее время еще не изучена.
Галогены образуют простые вещества, образованные двухатомными молекулами. F2 - желто-зеленый газ, т.кип. -188 °С, т.пл. -220 °С. Cl2 - зеленовато-желтый газ, т.кип. -34 °С, т.пл. -101 °С. Хлор легко сжижается при давлении более 6 атм. и комнатной температуре. Br2 - тяжелая красно-бурая жидкость, т.кип. 59 °С. I2 - черно-фиолетовые кристаллы с металлическим блеском, легко переходящие в газообразное состояние, минуя жидкое (сублимация, возгонка). Хлор, бром и иод плохо растворимы в воде, хорошо растворимы в некоторых органических растворителях. Фтор с водой реагирует.
Фтор и хлор чрезвычайно токсичны, вызывают глубокое поражение органов дыхания, отек слизистых и легких. Бром сильно разъедает кожу и резину. Иод в больших концентрациях токсичен и может вызвать поражение органов дыхания (иодный насморк), в умеренных концентрациях обладает дезинфицирующим действием.
Получение галогенов. Фтор получают электролизом раствора фторида калия в жидком фтористом водороде. Хлор в промышленности обычно получают электролизом раствора хлорида натрия или калия:
эл.ток
2КСl + 2H2O ® H2 + Cl2 + 2КОН
катод анод
Лабораторным методом получения хлора является окисление соляной кислоты перманганатом калия или диоксидом марганца (при нагревании):
t
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O;
t
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Бром и иод получают действием окислителей на растворы бромидов или хлоридов. В промышленных условиях дешевым и удобным окислителем является хлор:
2KI + Cl2 = 2KCl + I2
Химические свойства. В виде простых веществ галогены исключительно активные неметаллы. Особенно активен фтор, что обусловлено малой энергией диссоциации молекулы F2 (159 кДж/моль) и низкой энергией активации реакций с ее участием (меньше 4 кДж/моль). С водородом фтор реагирует уже при -252 °С.
H2 + F2 = 2HF
При температуре -190 °С фтор реагирует с серой и фосфором:
S + 3F2 = SF6; 2P + 5F2 = 2PF5
Активность фтора столь высока, что при высоких температурах он окисляет платину и тяжелые инертные газы:
t t
Pt + 2F2 = PtF4; Xe + 2F2 = XeF4
Непосредственно со фтором не взаимодействуют только гелий, неон, аргон, азот и углерод в виде алмаза.
Легко взаимодействует фтор с оксидами. В его атмосфере горят даже стекло и вода:
SiO2 + 2F2 = SiF4 + O2; 2H2O + 2F2 = 4HF + O2
Хлор по активности незначительно уступает фтору. Не взаимодействует только с инертными газами, кислородом и азотом. При низкой температуре реагирует с фосфором, мышьяком, сурьмой, кремнием, натрием и магнием. Фосфор и сера реагируют с хлором ступенчато:
2P + 3Cl2 = 2PCl3; 2S + Cl2 = S2Cl2;
PCl3 + Cl2 = PCl5; S2Cl2 + Cl2 = SCl2
При растворении в воде хлор частично с ней реагирует, диспропорционируя:
Cl2 + H2O  HCl + HOCl
HCl + HOCl
В растворах щелочей данное равновесие смещается вправо, при этом состав продуктов реакции определяется температурой:
0 °C
Cl2 + 2NaOH ¾® NaCl + NaClO + H2O;
>70 °C
3Cl2 + 6NaOH ¾® 5NaCl + NaClO3 + 3H2O
Химическая активность брома и иода по сравнению с хлором понижена, но вполне достаточна для взаимодействия с большинством неметаллов и металлов. В то же время бром и иод, равно как и хлор, окисляются фтором:
Br2 + 3F2 = 2BrF3
Иод окисляется также азотной кислотой:
3I2 + 10HNO3(конц) = 6HIO3 + 10NO + 2H2O
Хлор и бром довольно легко замещают атомы водорода в органических соединениях и присоединяются по кратным связям углерод - углерод:
hn
CH4 + Cl2 ® CH3Cl + HCl;
HCºCH + 2Cl2 ® Cl2HC-CHCl2
Фтор обычно разрушает органические соединения с выделением сажи и фтористого водорода. Реакции органических веществ с иодом осложняются неустойчивостью иодорганических соединений.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1913; Нарушение авторских прав?; Мы поможем в написании вашей работы!