
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения серы
|
|
|
|
Наиболее важными соединениями серыв степени окисления -2 являются сероводород и сульфиды.
Сероводород - H2S - бесцветный газ с характерным запахом гниющего белка, токсичен. Образуется при непосредственном взаимодействии водорода с парами серы. В лаборатории сероводород получают действием сильных кислот на сульфиды металлов:
Na2S + 2HCl = 2NaCl + H2S
Сероводород сильный восстановитель, окисляется даже оксидом серы(IV).
2H2S-2 + S+4O2 = 3S0 + 2H2O
На воздухе и в атмосфере кислорода сероводород горит, образуя серу или SO2 в зависимости от условий.
В воде сероводород малорастворим (2,5 объема H2S на 1 объем воды) и ведет себя как слабая двухосновная кислота.
H2S  H+ + HS-; К1 = 1×10-7
H+ + HS-; К1 = 1×10-7
HS-  H+ + S2-; К2 = 2,5×10-13
H+ + S2-; К2 = 2,5×10-13
Как двухосновная кислота сероводород образует два ряда солей: гидросульфиды (кислые соли) и сульфиды (средние соли). Например, NaНS - гидросульфид и Na2S - сульфид натрия.
Сульфиды большинства металлов в воде малорастворимы, окрашены в характерные цвета и отличаются по растворимости в кислотах: ZnS - белый, CdS - желто-оранжевый, MnS - телесного цвета, HgS, CuS, PbS, FeS - черные, SnS - бурый, SnS2 - желтый. В воде хорошо растворимы сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония. Растворимые сульфиды сильно гидролизованы.
Na2S + H2О  NaHS + NaOH
NaHS + NaOH
При нагревании растворы сульфидов растворяют серу с образованием полисульфидов
Na2S + (n-1)S = Na2Sn
При действии на растворы полисульфидов минеральных кислот выделены полисульфаны - нестойкие маслоподобные вещества состава H2Sn, где n изменяется от 2 до 23.
Основные соединения серыв степени окисления +4:
SF4 SOCl2 SO2 [SO3]2-
фторид серы(IV) оксохлорид серы(IV) оксид серы(IV) сульфит- анион
Фторид серы(IV) - бесцветный газ. Оксохлорид серы(IV) (хлористый тионил, тионилхлорид) - бесцветная жидкость с резким запахом. Эти вещества широко применяются в органическом синтезе для получения фтор- и хлорорганических соединений.
Наибольшее значение имеет оксид серы(IV) - бесцветный газ с резким неприятным запахом горящей серы. Молекула SO2 имеет угловое строение (угол OSO равен 119,5 °):

В промышленности SO2 получают обжигом пирита или сжиганием серы. Лабораторный метод получения диоксида серы - действие сильных минеральных кислот на сульфиты.
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
SO2 является энергичным восстановителем,
S+4O2 + Cl2 = S+6O2Cl2
но, взаимодействуя с сильными восстановителями, может выступать в роли окислителя:
2H2S + S+4O2 = 3S0 + 2H2O
Диоксид серы хорошо растворим в воде (40 объемов на 1 объем воды). В водном растворе гидратированные молекулы SO2 частично диссоциируют с образованием катиона водорода:
SO2×H2O  H+ + HSO3-
H+ + HSO3-  2H+ + SO32-
2H+ + SO32-
По этой причине водный раствор диоксида серы часто рассматривают как раствор сернистой кислоты - H2SO3, хотя реально это соединение, по-видимому, не существует. Тем не менее, соли сернистой кислоты устойчивы и могут быть выделены в индивидуальном виде:
SO2 + NaOH = NaHSO3; SO2 + 2NaOH = Na2SO3
гидросульфит натрия сульфит натрия
Сульфиты щелочных металлов хорошо растворимы в воде, в значительной мере гидролизованы:
SO32- + H2О  HSO3- + ОН-
HSO3- + ОН-
Сильные восстановители, при нагревании диспропорционируют:
t
4Na2S+4O3 = Na2S-2 + 3Na2S+6O4
Соединений серыв степени окисления +6:
SF6 SO2Cl2 SO3 H2SO4 [SO4]2-
фторид серы(VI) диоксодихлорид серы(VI) оксид серы(VI) серная кислота сульфат-анион

SF6 - бесцветный очень инертный газ, применяется в качестве газообразного диэлектрика. SO2Cl2 (хлористый сульфурил, сульфурилхлорид) - бесцветная жидкость, дымящаяся на воздухе вследствие гидролиза, применяется в органическом синтезе как хлорирующий реагент.
Оксид серы(VI) - бесцветная жидкость (т.кип. 44,8 °С, т.пл. 16,8 °С). В газообразном состоянии SO3 имеет мономерное строение, в жидком - преимущественно существует в виде циклических тримерных молекул, в твердом состоянии - полимер.
В промышленности триоксид серы получают каталитическим окислением ее диоксида.
t
2SO2 + O2 ¾® 2SO3
V2O5
В лаборатории SO3 можно получить перегонкой олеума - раствора триоксида серы в серной кислоте.
SO3 - типичный кислотный оксид, энергично присоединяющий воду и другие протонсодержащие реагенты:
SO3 + H2O = H2SO4; SO3 + HF = HOSO2F
фторсерная (фторсульфоновая)
кислота
Серная кислота - H2SO4 - бесцветная маслянистая жидкость, т.пл. 10,4 °С, т.кип. 340 °С (с разложением). Неограниченно растворима в воде, сильная двухосновная кислота. Концентрированная серная кислота - энергичный окислитель, особенно при нагревании. Она окисляет неметаллы и металлы, стоящие в ряду стандартных электродных потенциалов правее водорода:
t
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
t
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Взаимодействуя с более активными металлами, серная кислота может восстанавливаться до серы или сероводорода, например,
4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S + 4H2O
Холодная концентрированная серная кислота пассивирует многие металлы (железо, свинец, алюминий, хром) за счет образования на их поверхности плотной оксидной или солевой пленки.
Серная кислота образует два ряда солей, содержащие сульфат-анион - SO42- (средние соли) или гидросульфат-анион - HSO4- (кислые соли). Сульфаты в основном хорошо растворимы в воде, плохорастворимы BaSO4, SrSO4, PbSO4, Cu2SO4. Образование белого мелкокристаллического осадка сульфата бария при действии на раствор хлорида бария является качественной реакцией на сульфат-анион. Эта реакция применяется и для количественного определения серы.
Важнейшими солями серной кислоты является: Na2SO4×10H2O - мирабилит, глауберова соль - применяется при производстве соды и стекла; MgSO4×7H2O - горькая английская соль - применяется в медицине как слабительное, для отделки тканей, при дублении кожи; CaSO4×2H2O - гипс - применяется в медицине и строительстве; CaSO4×1/2H2O - алебастр - применяется как строительный материал; CuSO4×5H2O - медный купорос - используется в сельском хозяйстве для защиты растений от грибковых заболеваний; FeSO4×7H2O - железный купорос - применяется в сельском хозяйстве в качестве микроудобрения и при очистке воды в качестве коагулятора; K2SO4×Al2(SO4)3×24H2O - алюмокалиевые квасцы - применяются для дубления кож.
Синтез серной кислоты в промышленности осуществляется контактным методом, первой стадией которого является обжиг пирита:
t
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее оксид серы(IV) окисляют при 450 °С кислородом до оксида серы(VI) в контактном аппарате на катализаторе (V2O5):
t
2SO2 + O2 = 2SO3
Оксид серы(VI) растворяют в концентрированной серной кислоте с образованием олеума, разбавлением которого получают серную кислоту необходимой концентрации.
Пиросерная (двусерная) кислота - H2S2O7

Бесцветные легкоплавкие кристаллы, выделяющиеся из олеума.
SO3 + H2SO4 = H2S2O7
Соли пиросерной кислоты - пиросульфаты (дисульфаты) - получают термическим разложением гидросульфатов:
t
KHSO4 = K2S2O7 + H2O
Тиосерная кислота - H2S2O3

В водных растворах неустойчива и распадается с выделением серы и SO2
H2S2O3 = S¯ + SO2 + H2O
Соли тиосерной кислоты - тиосульфаты - устойчивы и могут быть получены кипячением серы с водными растворами сульфитов:
Na2SO3 + S = Na2S2O3
Тиосульфаты являются сильными восстановителями, тиосульфат натрия широко применяется в фотоделе как закрепитель и в аналитической химии для количественного определения иода и веществ, выделяющих иод (иодометрический анализ).
Политионовые кислоты - H2SxO6 (x = 2 - 6)

Политионовые кислоты неустойчивы, но образуют устойчивые соли - политионаты. Тетратионат натрия образуется при действии иода на водный раствор тиосульфата натрия:
Na2S2O3 + I2 = Na2S4O6 + 2NaI
Пероксосерные (надсерные) кислоты.

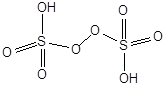
H2SO5 - мононадсерная кислота H2S2O8 - пероксодисерная кислота
(кислота Каро)
Пероксодисерная кислота получается при электролизе водного раствора серной кислоты:
2HSO4- - 2e- = H2S2O8
Образует соли - персульфаты. Персульфат аммония - (NH4)2S2O8 - применяется в лабораторных условиях как окислитель.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1863; Нарушение авторских прав?; Мы поможем в написании вашей работы!