
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения фосфора
|
|
|
|
Соединения фосфора в степени окисления -3 представлены фосфином - PH3 - и фосфидами металлов.
Фосфин - бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен! На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
PH3 + О2 = Р2O5 + H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Фосфиды щелочных и щелочноземельных металлов представляют собой типичные ионные соединения, гидролитически неустойчивы. Фосфиды d-металлов являются соединениями переменного состава (бертолидами), обычно тугоплавки и малореакционноспособны.
Наиболее важными соединениями фосфора в степени окисления -1 являются фосфорноватистая кислота и ее соли - гипофосфиты.
Фосфорноватистая кислота - H[H2PO2] - бесцветное кристаллическое вещество, хорошо растворимое в воде, сильная одноосновная кислота (Ka = 8×10-2).
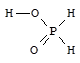
Фосфорноватистая кислота и гипофосфиты - сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует.
t
3H[H2PO2] = PH3 + 2H2[HPO2]
фосфористая кислота
Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте и ее солях - фосфитах. PF3 - газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H[H2PO3] + 3HCl
Оксид фосфора(III) - P2O3 (точнее P4O6) - бесцветное кристаллическое вещество, имеет молекулярное строение.
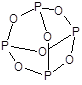
По химическим свойствам типичный кислотный оксид - ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая кислота - H2[HPO3] - бесцветные гигроскопичные кристаллы, хорошо растворимые в воде. H2[HPO3] является сильной двухосновной кислотой (K1 = 2×10-2, K2 = 6×10-7).
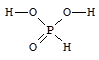
Соли фосфористой кислоты - фосфиты - сильные восстановители.
HgCl2 + H2[HPO3] + H2O = H3PO4 + Hg + 2HCl
Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) - газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
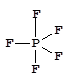
Аналогичное строение имеют другие галогениды фосфора(V) в газообразном состоянии. В кристаллах их строение соответствует следующим формулам: [PCl4]+[PCl6]-, [PBr4]+Br-. Галогениды фосфора - реакционноспособные и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]
PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) - P2O5, точнее P4O10 - бесцветное снегоподобное вещество.
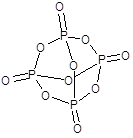
Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном итоге к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота - H4P2O7.
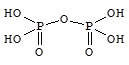
Ортофосфорная кислота - H3PO4 - бесцветные гигроскопичные кристаллы (т.пл. 42 °С) неограниченно растворимые в воде.

Кислота средней силы при диссоциации по первой ступени (K1 = 8×10-3), слабая - при диссоциации по второй и третьей ступеням (K2 = 6×10-8, K3 = 1×10-12). Образует три ряда солей: NaH2PO4 - дигидрофосфат натрия; Na2HPO4 - гидрофосфат натрия; Na3PO4 - фосфат (ортофосфат) натрия.
Фосфаты щелочных металлов и аммония хорошо растворимы в воде. Фосфаты остальных металлов малорастворимы. Переход к кислым солям сопровождается заметным повышением растворимости. Фосфаты щелочноземельных металлов и аммония применяются в качестве фосфорных удобрений: Ca3(PO4)2 - фосфоритная мука; CaHPO4×2H2O - преципитат; Ca(H2PO4)2×H2O - двойной суперфосфат; Ca(H2PO4)2×H2O + 2CaSO4 - суперфосфат; NH4H2PO4 + (NH4)2HPO4 - аммофос. Широко применяются комбинированные удобрения, содержащие несколько питательных элементов: аммофос + KNO3 - азофоска; (NH4)2HPO4 + NH4NO3 + KCl - нитрофоска
Фосфор образует значительное количество фосфорганических соединений, в которых он связан с органическими радикалами. Многие из них обладают ярко выраженным физиологическим действием, например:

хлорофос дихлофос
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1164; Нарушение авторских прав?; Мы поможем в написании вашей работы!