
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения углерода
|
|
|
|
Соединения углерода с водородом (углеводороды) составляют основу органических соединений и рассматриваются в курсе органической химии.
Карбиды металлов стехиометрического состава можно рассматривать как производные углеводородов. Большинство из них относятся к ряду метанидов (производных метана) или ацетиленидов (производных ацетилена). Это солеподобные кристаллические вещества, гидролиз которых приводит к образованию соответствующего углеводорода:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
метан
CaC2 + 2H2O = Ca(OH)2 + C2H2
ацетилен
Карбиды переходных металлов - бертолиды, например, TiC, ZrC, Mo2C, Fe3C. Многие из них проявляют металлические свойства, имеют характерный металлический блеск, высокую тепло- и электропроводность. Большинство из них имеют высокую твердость, жаропрочность, тугоплавкость и коррозионную устойчивость.
Оксид углерода(II) - СО - бесцветный газ без вкуса и запаха, малорастворим в воде, чрезвычайно токсичен (угарный газ). Механизм токсичного действия угарного газа основан на необратимом связывании гемоглобина крови. Строение молекулы передается следующей схемой:

В промышленности оксид углерода(II) получают восстановлением оксида углерода(IV) раскаленным коксом:
t
CO2 + C = 2CO
Лабораторный метод получения СО основан на разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты:
t
HCOOH ® CO + H2O
H2SO4
СО - несолеообразующий оксид, в обычных условиях не взаимодействует с водой, кислотами или щелочами. Однако в жестких условиях реагирует со щелочами, образуя соли муравьиной кислоты - формиаты:
t, p
NaOH + CO = HCOONa
Оксид углерода(II) - сильный восстановитель, легко окисляется кислородом и галогенами:
t t
2CO + O2 = 2CO2; CO + Cl2 = COCl2
t
CO + FeO = Fe + CO2
Непосредственно реагирует с никелем и железом, образуя карбонилы - координационные соединения, в которых СО выступает в роли лиганда.
60 °С t
Ni + 4CO = Ni(CO)4; Fe + 5CO = Fe(CO)5
тетракарбонил пентакарбонил
никеля железа
Цианистый водород – HCN - легкокипящая жидкость (т.кип. 27 °С) с характерным запахом горького миндаля. Сильнейший яд, смертельная доза около 50 мг. В промышленности получают взаимодействием оксида углерода(II) с аммиаком в автоклаве под давлением:
t
CO + NH3 = HCN + H2O
p
Cуществует в двух таутомерных формах с явной преобладанием первой из них:
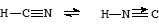
Цианистый водород неограниченно растворим в воде, в растворе ведет себя как слабая кислота (циановодородная или синильная кислота, К = 8×10-10). Соли - цианиды известны практически для всех металлов. Цианиды щелочных и щелочноземельных металлов хорошо растворимы и сильно гидролизованы, на воздухе медленно превращаются в карбонаты:
2KCN + CO2 + H2O = K2CO3 + 2HCN
Цианиды d-металлов в воде нерастворимы, но растворимы в растворах цианидов щелочных металлов:
Mn(CN)2¯ + 4KCN = K4[Mn(CN)6]
Цианиды очень сильные комплексообразующие реагенты, в присутствии окислителей растворяют серебро, золото и платину:
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH
Цианид-анион - сильный восстановитель:
2KCN + O2 = 2KCNO; KCN + S = KSNC
цианат калия тиоцианат калия
2Cu+2Cl2 + 4KCN = 2Cu+1CN + (CN)2 + 4KCl
дициан
Оксид углерода(IV) - CO2 - бесцветный газ, без вкуса и запаха. При давлении 6 атм переходит в жидкость, при быстром испарении которой образует кристаллическое вещество - сухой лед (сублимируется при -78 °С). Не поддерживает дыхание и горение, но вещества с большим сродством к кислороду горят в атмосфере диоксида углерода, например:
t
2Mg + CO2 = 2MgO + C
При повышенном давлении реагирует с водным раствором аммиака, образуя карбамид (мочевину):
t
CO2 + 2NH3 = OC(NH2)2 + H2O
p
Оксид углерода(IV) плохо растворим в воде, в которой ведет себя как слабая двухосновная кислота:
CO2 + H2O  CO2×H2O
CO2×H2O  H+ + HCO3-
H+ + HCO3-
В чистом виде угольная кислота не выделена и существует только в растворах, образуя два ряда солей.
CO2 + 2NaOH = Na2CO3; CO2 + NaOH = NaHCO3
карбонат натрия гидрокарбонат натрия
Карбонаты аммония и щелочных металлов (кроме лития) хорошо растворимы в воде и сильно гидролизованы:
CO32- + H2O  HCO3- + H+
HCO3- + H+
Карбонаты остальных металлов малорастворимы и термически нестойки:
t
CaCO3 = CaO + CO2
Карбонат кальция растворяется в воде в присутствии избытка СО2 с образованием гидрокарбоната:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Гидрокарбонаты в воде растворимы лучше, термически менее устойчивы, разрушаются уже при кипячении водного раствора:
t
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Карбонаты взаимодействуют с растворами сильных кислот с вытеснением угольной кислоты:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 427; Нарушение авторских прав?; Мы поможем в написании вашей работы!