
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция № 14. Окислительно-восстановительные реакции
|
|
|
|
Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления элементов (С.О.).
Степень окисления - это формальный заряд, рассчитанный в предположении, что электроны, участвующие в образовании химических связей, полностью смещены к партнеру с большей электроотрицательностью, т.е. все химические связи рассматриваются как ионные.
Формально окислительно-восстановительную реакцию можно рассматривать как реакцию, идущую с переносом электронов от одних атомов к другим. Элемент, атомы которого отдают электроны, увеличивая свою степень окисления, называется восстановителем, а процесс увеличения степени окисления называется окислением. Элемент, атомы которого присоединяют электроны, понижая степень окисления, называется окислителем. Процесс понижения степени окисления называется восстановлением.
Например, взаимодействие олова с хлором идет с образованием хлорида олова(IV) - SnCl4, содержащего ковалентные полярные связи Sn®Cl, в которых электронная плотность смещена от атома олова к более электроотрицательному атому хлора. Поэтому степень окисления хлора в данном соединении равна -1, а С.О. олова равна +4.
Sn0 + 2Cl02 = Sn+4Cl-14
Формально можно считать, что атом олова отдает четыре электрона, являясь восстановителем:
Sn0 - 4е- ® Sn+4 (окисление)
Атом хлора присоединяет один электрон и выступает в роли окислителя:
Cl0 + 1е- ® Cl-1 (восстановление)
Различают четыре типа окислительно-восстановительных реакций (ОВР):
1. Межмолекулярные ОВР, к которым относится рассмотренная выше реакция окисления олова хлором.
2. Внутримолекулярные ОВР, к которым относятся реакции разложения, например, разложение оксида ртути.
2Hg+2O-2 = 2Hg + O2
3. Реакции диспропорционирования, в которых в качестве окислителя и восстановителя выступают атомы одного и того же элемента в одной и той же степени окисления.
Cl02 + 2KOH = KCl-1 + KCl+1O + H2O
4. Реакции контрдиспропорционирования, обратные реакциям диспропорционирования.
5KI-1 + KI+5O3 + 3H2SO4 = 3I02 + 3K2SO4 + 3H2O
Существуют два метода подбора коэффициентов в уравнениях ОВР: метод электронного баланса и метод электронно-ионного баланса (метод полуреакций).
В основе метода электронного баланса лежит принцип равенства числа электронов, отданных восстановителем, и числа электронов, присоединенных окислителем. Подбор коэффициентов по данному методу целесообразно вести по следующему алгоритму:
1. Определить элементы, изменившие степени окисления.
2. Составить схемы процесса окисления и восстановления и привести их в соответствие с принципом электронного баланса.
3. Определить опорные коэффициенты и выставить их в уравнение реакции. При этом у веществ, выполняющих двойную функцию опорные коэффициенты не ставят.
4. Уравнять число атомов элементов, не изменивших степень окисления (кроме водорода и кислорода), в следующем порядке: в кислой и нейтральной среде уравниваются атомы металлов, затем кислотные остатки; в щелочной среде - наоборот.
5. Уравнять атомы водорода.
6. Проверить правильность подбора коэффициентов по числу атомов кислорода.
Рассмотрим действие алгоритма на конкретных примерах.
Пример № 1.
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
Расставим С.О. элементов:
KMn+7O4 + NaN+3O2 + H2SO4 ® Mn+2SO4 + NaN+5O3 + K2SO4 + H2O
При этом атом марганца является окислителем, понижая степень окисления от +2 до + 7 (процесс восстановления)
Mn+7 + 5е- ® Mn+2,
а атом азота повышает степень окисления от +3 до +5 (процесс окисления)
N+3 - 2е- ® N+5
Чтобы уравнять числа электронов, участвующих в процессах окисления и восстановления (привести схемы окисления и восстановления в соответствие с принципом электронного баланса), определим наименьшее общее кратное (10) и разделим его на число электронов каждого процесса:
Mn+7 + 5е- ® Mn+2 ½ 2
N+3 - 2е- ® N+5 ½ 5
Полученные числа позволяют определить опорные коэффициенты, от которых будут зависеть остальные коэффициенты в уравнении реакции.
2KMnO4 + 5NaNO2 + H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O
Далее, в соответствии с алгоритмом (кислая среда), уравняем число атомов металлов, не изменивших степени окисления (натрий и калий):
2KMnO4 + 5NaNO2 + H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O,
а затем число кислотных остатков (сульфат-анионы):
2KMnO4 + 5NaNO2 + 3H2SO4 ® 2MnSO4 + 5NaNO3 + K2SO4 + H2O
Затем уравняем число атомов водорода и проверим правильность подбора коэффициентов по кислороду:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
21 О 21 О
Пример № 2.
CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O
Определим элементы, изменившие степень окисления, составим схемы процессов окисления и восстановления и приведем их в соответствие с принципом электронного баланса.
Cr+3Cl3 + Br02 + KOH ® K2Cr+6O4 + KBr-1 + KCl + H2O
Cr+3 - 3е- ® Cr+6 ½ 2
Br02 + 2е- ® 2Br-1 ½ 3
Выставим опорные коэффициенты в уравнение реакции, обращая внимание на то, что они не всегда совпадают с числами, полученными по принципу электронного баланса, так как последние показывают число атомов, а не молекул или формульных единиц.
2Cr+3Cl3 + 3Br02 + KOH ® 2K2Cr+6O4 + 6KBr-1 + KCl + H2O
Реакция идет в щелочной среде, поэтому далее уравниваются кислотные остатки (хлорид-анионы):
2Cr+3Cl3 + 3Br02 + KOH ® 2K2Cr+6O4 + 6KBr-1 + 6KCl + H2O,
а затем числа атомов металлов, не изменивших степени окисления, в данном случае калия:
2Cr+3Cl3 + 3Br02 + 16KOH ® 2K2Cr+6O4 + 6KBr-1 + 6KCl + H2O
И наконец, уравниваем число атомов водорода, проверяем правильность подбора коэффициентов по кислороду:
2Cr+3Cl3 + 3Br02 + 16KOH = 2K2Cr+6O4 + 6KBr-1 + 6KCl + 8H2O
16 О 16 О
Пример № 3.
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO
Особенностью данной реакции является то, что изменяют степени окисления три элемента, причем два из них (восстановители) входят в состав одного вещества - сульфида мышьяка(III).
As+32S-23 + HN+5O3 + H2O ® H3As+5O4 + H2S+6O4 + N+2O
В этом случае схема процесса окисления составляется целиком на молекулу восстановителя:
As+32S-23 - 28е- ® 2As+5 + 3S+6
Окислителем в данной реакции является атом азота азотной кислоты, присоединяющий два электрона и снижающий степень окисления от +5 до +3.
N+5 + 3е- ® N+2
Приведем схемы в соответствие с принципом электронного баланса и выставим опорные коэффициенты в уравнении реакции:
As+32S-23 - 28е- ® 2As+5 + 3S+5 ½ 3
N+5 + 3е- ® N+2 ½ 28
3As2S3 + 28HNO3 + 4H2O ® 6H3AsO4 + 9H2SO4 + 28NO
В данной реакции нет кислотных остатков, элементы которых не изменяют степень окисления, также нет атомов металлов, поэтому далее уравняем число атомов водорода и проверим правильность подбора коэффициентов по кислороду:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO
Пример № 4.
Cl20 + KOH ® KCl-1 + KCl+5O3 + H2O
Эта реакция относится к реакциям диспропорционирования, особенностью которых, как уже отмечалось, является то, что степень окисления изменяет атом одного элемента. При этом часть атомов выступает в роли окислителя, а часть - в роли восстановителя.
Cl0 + 1e- ® Cl-1 ½ 5
Cl0 - 5e- ® Cl+5 ½ 1
При выставлении опорных коэффициентов в правой части уравнения необходимо ориентироваться по степеням окисления элемента. В качестве опорного коэффициента в левой части уравнения используется сумма опорных коэффициентов правой части.
3Cl2 + KOH ® 5KCl + KClO3 + H2O
Далее по алгоритму:
3Cl2 + 6KOH ® 5KCl + KClO3 + H2O
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Пример № 5.
CH3COH + KMnO4 + H2SO4 ® CH3COOH + MnSO4 + K2SO4 + H2O
Особенностью органических соединений является то, что для них степени окисления элементов не определяют. При составлении схем электронного баланса в данном случае руководствуются следующими правилами:
· присоединение атома кислорода тождественно потере молекулой двух электронов;
· отщепление атома кислорода тождественно присоединению двух электронов;
· присоединение атома водорода тождественно присоединению одного электрона;
· отщепление атома водорода тождественно потере одного электрона.
CH3COH + [O] - 2e- ® CH3COOH ½ 5
Мn+7 + 5e- ® Mn2+ ½ 2
Далее по алгоритму:
5CH3COH + 2KMnO4 + H2SO4 ® 5CH3COOH + 2MnSO4 + K2SO4 + H2O
5CH3COH + 2KMnO4 + 3H2SO4 ® 5CH3COOH + 2MnSO4 + K2SO4 + H2O
5CH3COH + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + K2SO4 + H2O
Недостатком метода электронного баланса является использование в уравнениях несуществующих реально частиц (Mn+7, N+5 и т.д.). Этого недостатка лишен метод электронно-ионного баланса, в котором в схемах процессов окисления и восстановления допускается использование только реальных частиц. Этот метод более адекватно отражает процессы, протекающие в растворах.
Пример № 6.
KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
Схема процесса восстановления перманганат-аниона (см. пример № 1) теперь будет выглядеть следующим образом:
MnO4- + 8H+ + 5е- ® Mn2+ + 4H2O
Окисление нитрит-аниона описывается следующим уравнением:
NO2- + H2O - 2е- ® NO3- + 2H+
В соответствии с принципом электронного баланса первое уравнение необходимо умножить на 2, а второе - на 5.
MnO4- + 8H+ + 5е- ® Mn2+ + 4H2O ½ 2
NO2- + H2O - 2е- ® NO3- + 2H+ ½ 5
Суммирование уравнений и сокращение общих частиц, находящихся в левой и правой частях, дает сокращенное ионное уравнение окислительно-восстановительной реакции:
2MnO4- + 16H + + 5NO2- + 5H2O ® 2Mn2+ + 8H2O + 5NO3- + 10H +;
2MnO4- + 5NO2- + 6H+ = 2Mn2+ + 5NO3- + 3H2O
Литература: [1] c. 255 - 263; [2] с. 317 - 326; [3] с. 206 - 210
Лекция № 15. Электродные потенциалы. Химические источники тока. Электролиз
Электродным потенциалом называется разность потенциалов, возникающая на поверхности металлической пластинки, погруженной в раствор соли данного металла. В зависимости от активности металла возможны два механизма возникновения скачка потенциала на поверхности металлического электрода.
Для активных металлов наблюдается обратимый переход катионов в раствор, обуславливающий возникновение отрицательного заряда на поверхности пластинки, притягивающей катионы из раствора с образованием двойного электрического слоя, переход через который сопровождается скачком потенциала (Dj).

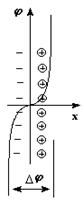
Для малоактивных металлов причиной возникновения скачка потенциала является адсорбция катионов металла из раствора на поверхности металлической пластинки с образованием двойного электрического слоя за счет притяжения из раствора анионов соли.

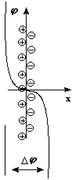
Измерить абсолютное значение скачка потенциала на поверхности металлической пластинки экспериментально невозможно, поэтому определяют или рассчитывают величину электродного потенциала относительно стандартного водородного электрода, потенциал которого принят за ноль. Водородный электрод представляет собой платиновую пластину, покрытую мелким платиновым порошком (платиновой чернью), погруженную в раствор серной кислоты с активностью катионов водорода 1 моль/л при температуре 298К (25 °С). На пластину подается газообразный водород под давлением 101,325 кПа. Адсорбирующийся на поверхности платины водород способен передавать электроны катионам водорода, вследствие чего на поверхности электрода устанавливается равновесие аналогичное равновесным процессам, возникающим на поверхности металлических электродов:
2H+ + 2e-  H2
H2
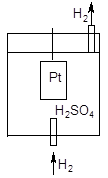
Схема строения водородного электрода
Электродный потенциал, определенный в стандартных условиях (p = 101,325 кПа, Т = 298К, а(Н+) = 1 моль/л), называется стандартным (E°). Стандартные электродные потенциалы можно найти в соответствующих справочных таблицах. Рассчитать величину электродного потенциала в условиях, отличающихся от стандартных, позволяет уравнение Нернста:
 ,
,
где F - постоянная Фарадея (96500 А×с), R - универсальная газовая постоянная, n - число электронов, участвующих в процессе, [Mn+] - равновесная концентрация катионов металла.
При 25 °С уравнение примет следующий вид:
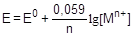
По аналогии с электродным потенциалом определяется окислительно-восстановительный потенциал - разность потенциалов, возникающая на поверхности гладкой платиновой пластины, погруженной в раствор, содержащий окисленную и восстановленную форму вещества. Расчет окислительно-восстановительного потенциала также выполняется на основании уравнения Нернста:
 ,
,
где E0 - стандартный окислительно-восстановительный потенциал, [Ox], [Red] - равновесные концентрации окисленной и восстановленной форм. Например, для пары MnO4-/Mn2+, связанной уравнением
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O
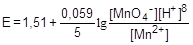
Зная величины окислительно-восстановительных потенциалов, можно определить направление протекания окислительно-восстановительной реакции. Для этого пользуются следующим правилом: окислителем является та пара, у которой потенциал больше.
Определим, например, направление следующей реакции:
?
KMnO4 + FeSO4 + H2SO4  MnSO4 + Fe2(SO4)3 + H2O
MnSO4 + Fe2(SO4)3 + H2O
Для этого выделим две пары частиц, находящихся в окисленной и восстановленной форме, и найдем в справочнике их стандартные окислительно-восстановительные потенциалы:
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O, E0 = 1,51В
Fe3+ + e- ® Fe2+, E0 = 0,77 В
Поскольку у первой пары потенциал больше, она и будет выступать в качестве окислителя, т.е. реакция будет протекать в следующем направлении:
KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + H2O
Химические источники тока. Как уже отмечалось, окислительно-восстановительная реакция, сопровождается переносом электронов от восстановителя к окислителю. Если разделить процессы окисления и восстановления в пространстве, можно получить направленный поток электронов, т.е. электрический ток. Устройства, в которых энергия окислительно-восстановительной реакции преобразуется в энергию электрического тока, называются химическими источниками тока или гальваническими элементами. Рассмотрим принцип действия гальванического элемента на примере элемента Даниэля-Якоби, который представляет собой замкнутые в одну цепь цинковый и медный электроды.

Электрод, изготовленный из более активного металла (металл, имеющий более низкий потенциал), всегда будет анодом. В данном случае на цинковом аноде идет процесс окисления цинка:
Zn ® Zn2+ + 2e-
На медном катоде идет восстановление катионов меди:
Cu2+ + 2e- ® Cu0
Электроны, перемещаясь по внешней цепи, совершают полезную работу. Чтобы цепь была замкнута, растворы соединены солевым мостиком (обычно раствор агар-агара, содержащий сульфат калия). Рассчитать ЭДС, которую развивает элемент, можно по величине электродных потенциалов:
ЭДС = Екатода - Еанода
В стандартных условий E0(Cu2+/Cu) = 0,34 В; E0(Zn2+/Zn) = -0,76 В, поэтому:
ЭДС = 0,34 В - (-0,76 В) = 1,10 В
Таким образом, в гальваническом элементе энергия самопроизвольно протекающей окислительно-восстановительной реакции преобразуется в энергию электрического тока.
Электролиз. При пропускании электрического тока через раствор или расплав электролита можно провести окислительно-восстановительные реакции, не идущие самопроизвольно. Данный процесс называется электролизом. Процессы, протекающие на электродах при электролизе, зависят как от природы электролита, так и от среды, в которой он находится. При электролизе расплава на катоде идет процесс восстановления катиона электролита, а на аноде - окисление его аниона. Например, электролиз расплава хлорида натрия описывается следующими уравнениями:
Катодный процесс: Na+ + e- ® Na
Анодный процесс: 2Cl- - 2e- ® Cl2
Суммарно 2NaCl = 2Na + Cl2
При электролизе водных растворов в электродных процессах могут принимать участие молекулы воды.
Катодный процесс: 2H2O + 2e- ® H2 + 2OH- или 2H+ + 2e- ® H2
Анодный процесс: 2H2O - 4e- ® O2 + 4H+ или 4OH- - 4e- ® O2 + 2H2O
Фактически при электролизе водных растворов наблюдается конкуренция между электродными процессами. Выбор между ними можно сделать на основании следующих правил:
1. Если металл стоит в ряду стандартных электродных потенциалов правее водорода, на катоде восстанавливается металл.
2. Если металл стоит в ряду стандартных электродных потенциалов левее алюминия (включительно), на катоде восстанавливается водород.
3. Если металл в ряду стандартных электродных потенциалов стоит между алюминием и водородом, на катоде идет параллельно восстановление металла и водорода.
4. Если электролит содержит анионы кислородсодержащих кислот или фторид-анион, на аноде окисляется вода. Во всех остальных случаях на аноде окисляется анион электролита.
Применение данных правил рассмотрим на конкретных примерах.
Пример №1. Электролиз водного раствора хлорида натрия.
NaCl = Na+ + Cl-
Катодный процесс: 2H+ + 2e- ® H2
Анодный процесс: 2Cl- - 2e- ® Cl2
Суммарно 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Пример №2. Электролиз водного раствора нитрата натрия.
NaNO3 = Na+ + NO3-
Катодный процесс: 2H2O + 2e- ® H2 + 2OH-
Анодный процесс: 2H2O - 4e- ® O2 + 4H+
Суммарно 2H2O = O2 + 2H2
Пример №3. Электролиз водного раствора сульфата меди.
CuSO4 = Cu2+ + SO42-
Катодный процесс: Cu2+ + 2e- ® Cu
Анодный процесс: 2H2O - 4e- ® O2 + 4H+
Суммарно 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2
В рассмотренных примерах считалось, что электроды изготовлены из инертного материла и участия в процессе электролиза не принимают. В том случае, когда материал электродов, точнее анода, не инертен, он может подвергаться окислению.
Пример №4. Электролиз водного раствора сульфата меди с медным анодом.
Катодный процесс: Cu2+ + 2e- ® Cu
Анодный процесс: Cu - 2e- ® Cu2+
Суммарный процесс сводится к переносу материала анода (медь) на катод.
Количественно электролиз описывается законами Фарадея:
· Масса вещества, образующегося при электролизе, прямо пропорциональна количеству электричества (заряду), прошедшему через раствор.
· Равные количества электричества приводят к превращению эквивалентных количеств разных веществ.
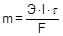 ,
,
где Э - молярная масса эквивалента (эквивалентная масса), I - сила тока, t - время. Заряд, необходимый для электрохимического превращения одного моля эквивалента, равен 96500 Кл (А×с) и называется постоянной Фарадея (F).
Литература: [1] с. 263 - 293; [2] с. 326 - 360; [3] с. 214 - 216
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1659; Нарушение авторских прав?; Мы поможем в написании вашей работы!