
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные параметры химических связей
|
|
|
|
Химическая связь. Строение молекулы
Молекула представляет собой сложное образование, включающее в себя несколько ядер и распределенную между ними электронную плотность. В 1925г. В.Коссель и Г.Льюис предложили теорию химической связи, согласно которой при образовании химической связи атомы стремятся приобрести устойчивую электронную конфигурацию благородных газов ns2 np6, что соответствует минимуму энергии системы.
В зависимости от характера распределения электронной плотности различают ковалентную, ионную, металлическую связь.
Химическая связь характеризуется энергией, длиной и валентным углом (линиями, соединяющими ядра атомов).
Энергия связи – энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия является мерой прочности химической связи. Чем больше энергия связи, тем прочнее связь.
Длина связи – расстояние между центрами ядер атомов в молекуле. Чем меньше длина связи, тем прочнее связь.
При образовании молекул будут действовать силы двух типов: силы отталкивания между ядрами и силы притяжения между электронами и ядрами. Химическая связь образуется только в том случае, если при сближении атомов полная энергия системы понижается. В 1927 году Гейтлер и Лондон провели квантово-механический расчет строения молекулы водорода.
Оказалось, что при совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы, что требует затраты энергии. Такой процесс оказывается энергетически невыгодным, и химическая связь между ними не возникает (рис.1,кривая 2).
 При противоположно направленных спинах сближение атомов до некоторого расстояния ℓ сопровождается уменьшением энергии системы (рис.1, кривая 1). При ℓ = Е система обладает наименьшей потенциальной энергией, то есть находится в наиболее устойчивом положении. Это означает, что при сближении двух атомов водорода с антипараллельными спинами возможно образование молекулы водорода.
При противоположно направленных спинах сближение атомов до некоторого расстояния ℓ сопровождается уменьшением энергии системы (рис.1, кривая 1). При ℓ = Е система обладает наименьшей потенциальной энергией, то есть находится в наиболее устойчивом положении. Это означает, что при сближении двух атомов водорода с антипараллельными спинами возможно образование молекулы водорода.
Рис 1. Зависимость энергии систем двух
атомов водорода с антипараллельными(1)
и параллельными(2) спинами от расстояния
между ядрами
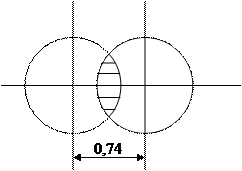
Рис.2 Перекрывание электронных облаков
при образовании молекулы водорода
Следовательно, можно сделать вывод о том, что химическая связь образуется за счет перекрывания электронных облаков с антипараллельными спинами.
Один из методов, дающий представление о механизме образования химической связи - метод валентных связей.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 530; Нарушение авторских прав?; Мы поможем в написании вашей работы!