
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод валентных связей. Ковалентная связь
|
|
|
|
Основные положения метода валентных связей (МВС):
· ковалентная связь образуется за счет перекрывания атомных орбиталей валентных электронов с антипараллельными спинами;
· перекрываются только облака неспаренных валентных электронов;
· в результате взаимодействия электронов в атомах образуется общая электронная пара, возникает единое электронное облако высокой плотности, которое находится между ядрами атомов.
Ковалентная связь - химическая связь, образованная путем обобществления пары электронов двумя атомами.
Различают два механизма образования ковалентных связей: обменный и донорно-акцепторный.
Обменный механизм заключается в том, что каждый из взаимодействующих атомов для образования общих электронных пар предоставляет свои неспаренные электроны.
Например:
|
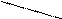

 H: 1s1 ↑
H: 1s1 ↑
|
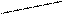
 H: 1s1 ↓
H: 1s1 ↓
Донорно-акцепторный механизм заключается в том, что один из атомов – донор отдает свою пару электронов на свободную орбиталь другого атома – акцептора. Например: азот – донор, водород – акцептор
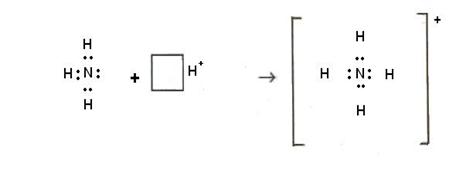
Донорно-акцепторный механизм лежит в основе образования комплексных соединений.
Свойства ковалентной связи:
· насыщаемость характеризует способность атомов элементов образовывать определенное число связей, т.е. показывает состав молекулы. Максимальное число связей определяется количеством неспаренных электронов и наличием свободных орбиталей. Число неспаренных валентных электронов при обменном механизме является мерой валентности (ковалентности) атома.
Например, молекула аммиака состоит из одного атома азота и трех атомов водорода.
 ↓ ↓
|  ↓ ↓
|  ↓ ↓
| |||
|
14N: 2s22p3






1H:1s1
У атома водорода один неспаренный электрон, у атома азота – три неспаренных валентных электрона. Следовательно, один атом азота может образовать три связи с тремя атомами водорода, образуя молекулу NH3;
· направленность: так как при образовании молекулы происходит перекрывание электронных плотностей, то это перекрывание может идти в двух направлениях:
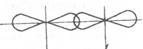 1) По линии связи ядер атомов – это σ-связь
1) По линии связи ядер атомов – это σ-связь
 а)
а)
б)
|
|
Для s-облаков характерна только σ-связь.
2) Перпендикулярно линии, связывающей центры ядер – π-связь.
|
Направленность связи показывает пространственную структуру молекул, их геометрическую форму.
· полярность: ковалентная связь считается полярной (КПС), если образована атомами с разной электроотрицательностью и неполярной (КНПС) – с одинаковой электроотрицательностью (см. приложение).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 509; Нарушение авторских прав?; Мы поможем в написании вашей работы!