
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
Соли марганца (II)
Химические свойства
Получение
Гидроксид марганца (II)
Химические свойства
Оксид марганца (II) принадлежит к основным оксидам, обладает всеми их свойствами. Ему соответствует нестойкий гидроксид Mn(OH)2.
Гидроксид марганца (II) - Mn(OH)2 – нерастворимое в воде вещество светло-розового цвета.
Основной способ получения – щелочная обработка солей марганца (II):
MnSO4 + 2NaOH → Mn(OH)2↓ + Na2SO4
На воздухе окисляется до гидроксида марганца (IV):
2Mn(OH)2↓ + O2 + 2H2O → 2Mn(OH)4↓
Проявляет все свойства нерастворимых в воде оснований.
Все соли марганца (II) в окислительно-восстановительных реакциях, протекающих в растворах, являются восстановителями:
3Mn(NO3)2 + 2KMnO4 + 2H2O → 5MnO2 + 4HNO3 + 2KNO3
Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
Mn2+ + 6H2O → [Mn(H2O)6]2+
MnCl2 + 6H2O → [Mn(H2O)6]Cl2
Соли марганца (II) образуют комплексы.
Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Аналогично:
4KF + MnF2 = K4[MnF6]
2KCl + MnCl2 = K2[MnCl4]
Соединения марганца (III)
Mn2O3 – амфотерный оксид, с преобладанием основных свойств.
Mn2O3 + 6HF = 2MnF3 + 3H2O
Mn+32O3 + NaOH = 2NaMnO2 + H2O (t)
Mn(OH)3 – гидроксид Mn3+ - амфотерное соединение, с преобладанием основных свойств:
Mn(OH)3 ↔ HMnO2
Соединения марганца (IV)
К основным соединениям четырехвалентного марганца относятся оксид марганца (IV) MnO2, а также марганцеватистая кислота H2MnO3 – очень неустойчивая, легко разлагающаяся на оксид марганца (IV) и воду.
 Самым прочным соединением марганца (IV) является нерастворимый в воде оксид темно-бурого цвета. Это амфотерное соединение, но соответствующие свойства выражены крайне слабо.
Самым прочным соединением марганца (IV) является нерастворимый в воде оксид темно-бурого цвета. Это амфотерное соединение, но соответствующие свойства выражены крайне слабо.
|
MnO2 + 2NaOH = Na2MnO3 + H2O
MnO2 может проявлять в ОВ-реакциях в зависимости от природы партнера как окислительные, так и восстановительные свойства (окислительно-восстановительная двойственность).
Гораздо чаще используют оксид марганца (IV) в качестве окислителя, проводя реакции в кислой среде:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
В щелочной среде оксид марганца (IV) может быть и восстановителем, превращаясь в соединения марганца (VI), например, соли марганцовистой кислоты – манганаты:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
Влияние рН на ОВ-реакции MnO2

Соединения марганца (VI)
MnO3 – оксид, обладает кислотными свойствами.
H2MnO4 – марганцовистая кислота – существует только в растворе.
Соли этой кислоты – манганаты.
Манганаты могут быть получены прокаливанием сухих перманганатов:
+7 -2 +6 +4 0
2KMnO4 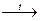 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Манганаты устойчивы в сильнощелочной среде, в нейтральной среде протекает реакция диспропорционирования:
+6 +7 +4
3Na2MnO4 + 2H2O → 2NaMnO4 + MnO2 + 4NaOH
Соединения марганца (VII)
Высшей степени окисления марганца +7 соответствует кислотный оксид Mn2O7, марганцевая кислота HMnO4 и ее соли – перманганаты.
Соединения марганца (VII) – сильные окислители. Mn2O7 – зеленовато-бурая маслянистая жидкость, при соприкосновении с которой спирты и эфиры воспламеняются. Оксиду Mn (VII) соответствует марганцевая кислота HMnO4. Она существует только в растворах, но считается одной из самых сильных (α – 100%). Максимально возможная концентрация HMnO4 в растворе – 20%. Соли HMnO4 – перманганаты – сильнейшие окислители; в водных растворах, как и сама кислота, имеют малиновую окраску.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями. В зависимости от реакции среды они восстанавливаются либо до солей двухвалентного марганца (в кислой среде), оксида марганца (IV) (в нейтральной) или соединений марганца (VI) – манганатов – (в щелочной). Очевидно, что в кислой среде окислительные способности Mn+7 выражены наиболее ярко.

+7 +4 +2 +6
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
+7 +4 +4 +6
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 3Na2SO4 + 2KOH
+7 +4 +6 +6
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
+7 +2
2KMnO4 + 3H2SO4 + 5C2H5OH → 2MnSO4 + K2SO4 + 5CH3COH + 8H2O
спирт альдегид
+7 +4 +6
4KMnO4 + 2NaOH + C2H5OH → MnO2↓ + 3CH3COH + 2K2MnO4 +
+6
Na2MnO4 + 4H2O
При нагревании перманганат калия разлагается (эта реакция применяется для получения кислорода в лабораторных условиях):
2KMnO4 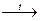 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Таким образом, для марганца характеры те же зависимости: при переходе от низшей степени окисления к высшей нарастают кислотные свойства кислородных соединений, а в ОВ-реакциях восстановительные свойства сменяются окислительными.
Для организма перманганаты ядовиты вследствие сильных окислительных свойств.
При отравлениях перманганатами в качестве антидота используют пероксид водорода в уксуснокислой среде:
+7 -1 +2 0
2KMnO4 + 5H2O2 + 6CH3COOH → 2(CH3COO)2Mn + 2CH3COOK + 5O2↑ + 8H2O
Раствор KMnO4 является прижигающим и бактерицидным средством для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства KMnO4 в кислой среде лежат в основе аналитического метода перманганатометрии, используемого в клиническом анализе для определения окисляемости воды, мочевой кислоты в моче.
Организм человека содержит около 12 мг Mn в составе различных соединений, причем 43% сосредоточено в костной ткани. Он оказывает влияние на кроветворение, формирование костной ткани, рост, размножение и некоторые другие функции организма.
Тема: D-элементы VIII группы
Ключевые слова: d-элементы, железо, кобальт, никель, триады – d-элементов, семейство железа, феромагнитные соединения, комплексооразующая способность, пассивация на холоду кислотами, карбонилы железа, кристаллогидраты, желтая и красная кравяные соли, ферраты, соль Мора, железная кислота.
Особенность VIII В-группы состоит в том, что она объединяет 3 триады d-элементов больших периодов, не имеющих электронных аналогов в малых периодах.
Элементы первой триады – Fe, Co, Ni – называют семейством железа. Элементы второй и третьей триад, то есть Ru (рутений), Rh (родий), Pd (палладий), Os (осмий), Ir (иридий), Pt (платина), именуются платиновыми металлами.
Атомы элементов семейства железа в отличие от атомов платиновых металлов не имеют свободного f-подуровня.
Этот факт обуславливает химические особенности элементов семейства железа.
Платиновые металлы, очень сходные по свойствам и трудноотделимые друг от друга, резко отличаются от металлов семейства железа и никогда не встречаются вместе с ними в литосфере.
У элементов VIII В-группы почти полностью достраивается d-подуровень предвнешнего уровня. Однако не все электроны d-подуровня участвуют в образовании химических связей. Только около 10 лет назад было получено соединение железа со степенью окисления +8, чаще же в сложных соединениях для железа характерны степени окисления +3 и +2; у Со +3, а у Ni +2. Для металлов VIII В-группы характерны высокие плотности и температуры плавления. Fe, Co, Ni – ферромагниты; все элементы VIII В-группы хорошие комплексообразователи.
Элементы семейства железа – металлы со средней химической активностью. В ряду стандартных электродных потенциалов расположены левее водорода. Платиновые металлы расположены в конце ряда стандартных электродных потенциалов и отличаются низкой химической активностью.
Платиновые металлы используются в приборостроении, как катализаторы в оргсинтезе и для получения коррозионно-устойчивых сплавов.
Элементы семейства железа расположены в четвертом периоде периодической системы химических элементов. Fe, Co – серебристо-белые металлы, Ni имеет желтовато-белый цвет.
Для железа и кобальта в сложных веществах наиболее характерны степени окисления +2 и +3, а для никеля +2. Подобно элементам подгруппы марганца, способны образовывать соединения со степенью окисления 0 (карбонилы):
[Fe(CO)5], [Co(CO)8], [Ni(CO)4]
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 15946; Нарушение авторских прав?; Мы поможем в написании вашей работы!