
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение железа и железосодержащих препаратов в медицине и фармации
|
|
|
|
Соединения железа (VI)
Химические свойства
1. Все растворимые соли Fe3+ в водных растворах сильно гидролизованы:
Fe3+ + H2O ↔ FeOH2+ + H+
FeOH2+ + H2O ↔ Fe(OH)2+ + H+
Fe(OH)2+ + H2O ↔ Fe(OH)3↓ + H+
Водные растворы солей Fe3+ имеют сильнокислую реакцию.
Соли Fe3+ с анионами слабых кислот подвергаются необратимому гидролизу.
2. В реакциях с сильными восстановителями соли Fe3+ проявляют окислительную активность:
2FeCl3 + 2KI = 2FeCl2 + I2↓ + 2KCl
Fe2(SO4)3 + H2S = 2FeSO4 + S↓ + H2SO4
3. При действии щелочей и водных растворов аммиака на растворы солей Fe3+ образуется осадок:
Fe3+ + 3OH- = Fe(OH)3↓
4. Качественные реакции для обнаружения катионов Fe3+:
а) 4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]3↓
желтая кровяная соль берлинская лазурь
(темно-синий осадок)
б) Fe3+ + 3SCN- ↔ Fe(SCN)3 роданид Fe (III) (р-р кроваво-красного цвета)
Железо реализует степень окисления +6 в тетраэдрическом анионе FeO42- - тетраоксоферрат анионе:
+3 +5 спл. +6 +3
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
Оксоферраты – кристаллические вещества красно-фиолетового цвета. Ферраты при нагревании в водных растворах разлагаются с выделением кислорода. По окислительной способности превосходят перманганаты:

Железная кислота H2FeO4, солями которой являются ферраты, не получена.
Ангидрид кислоты – FeO3 также не получен.
В организме человека содержится около 5 г железа в составе различных соединений, причем около 70% сосредоточено в гемоглобине крови. Железо входит также в состав белка мышечной ткани – миоглобина. Это сложные белки, в состав которых входит железо (II), связывающее в комплекс порфириновый лиганд
В организме человека существует большая группа (около 50 видов) ферментов – цитохромов, которые катализируют перенос электронов в дыхательной цепи за счет изменения степени окисления железа:
|
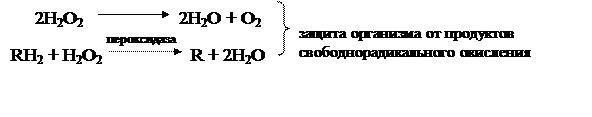
При недостатке железа в организме развивается железодефицитная анемия. Для пополнения запаса железа с пищей ежедневно должно поступать около 1 мг, но поскольку усваивается лишь 10-20% железа, то пища должна содержать 5-10 мг/сут. в пересчете на свободный элемент. для лечения железодефицитной анемии применяют аскорбинат железа (II), лактат железа (II), FeSO4•7H2O, «ферроплекс» (FeSO4 + аскорбиновая кислота), глицерофосфат железа (III).
В аналитической практике для приготовления стандартных растворов Fe2+ используют соль Мора:
(NH4)2SO4•FeSO4•6H2O
Тема: Р – элементы III группы
Ключевые слова: p-элементы, бор, алюминий, электронная дифицитность,амфотерные элемент, бориды, галиды, аморфный порошок, гидриды, бораны, трехцентровые связи, гидридобараты, борный ангидрид, борная кислота, метоборная кислота, бораты, бура, фармакологическое действие, алюминаты, квасцы, гидрид алюминия.
Элементы третьей группы — бор, алюминий, галлий, индий и таллий — характеризуются наличием трех электронов в наружном электронном слое атома. Бор и алюминий – элементы с дефицитом электронов. Металлические свойства рассматриваемых элементов с увеличением порядкового номера заметно усиливаются. Бор – неметаллический элемент, алюминий – амфотерный элемент, таллий – металлический элемент. В соединениях рассматриваемые элементы проявляют степень окисления + 3. Однако с возрастанием атомной массы появляются и более низкие степени окисления. Для последнего элемента группы – таллия – наиболее устойчивы соединения, в которых его степень окисления равна + 1.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 3236; Нарушение авторских прав?; Мы поможем в написании вашей работы!