
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи и упражнения для самостоятельного решения. 20.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 = ;
|
|
|
|
20.1. Закончить уравнения реакций: а) K2Cr2O7 + KI + H2SO4 = …;
б) CrO3 + NaOH = …; в) CrCl3 + H2O ↔ …; г) Cr2O3 + H2SO4 =….
20.2. Вычислить тепловой эффект реакции получения хрома по стандартным энтальпиям образования: Cr2O3 + 2Al = Al2O3 + 2Cr.
(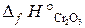 = –1440,6 кДж/моль;
= –1440,6 кДж/моль;  = –1676 кДж/моль).
= –1676 кДж/моль).
(Ответ: –235,4 кДж).
20.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → CrCl3.
20.4. Закончить уравнения реакций: а) NaCrO2 + PbO2 + NaOH = …;
б) K2Cr2O7 + FeSO4 + H2SO4 = …; в) Cr2(SO4)3 + H2O ↔ ….
20.5. Какой объем хлора при нормальных условиях выделится при взаимодействии одного моля дихромата натрия с избытком соляной кислоты?
(Ответ: 67,2 л).
20.6. Составить уравнения реакций взаимодействия в щелочной среде хлорида хрома (III): а) с бромом (Br2); б) с пероксидом водорода (H2O2).
20.7. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6].
20.8. Можно ли восстановить хром из его оксида алюминием? Ответ мотивировать, вычислив Δ G° реакции: Cr2O3 + 2Al = Al2O3 + 2Cr.
( = –1050 кДж/моль;
= –1050 кДж/моль;  = –1582 кДж/моль).
= –1582 кДж/моль).
20.9. Составить уравнения реакций взаимодействия в щелочной среде сульфата хрома (III): а) с бромом (Br2); б) с диоксидом свинца (PbO2).
20.10. Учитывая, что координационное число хрома (III) равно 6, написать уравнения реакций образования комплексных соединений хрома и назвать их: а) CrCl3 + KCN (избыток) = …; б) Cr(OH)3 + NaOH (избыток) = …;
в) CrCl3 + NH4OH (избыток) = ….
20.11. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей хрома: а) Cr2(SO4)3 + K2CO3 + H2O = …;
б) Cr(NO3)3 + H2O ↔ …; в) CrCl3 + Na2S + H2O = ….
20.12. Вычислить молярную массу эквивалентов и эквивалент восстановителя в реакции
2СrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8H2O.
20.13. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают степени окисления +6 и +3. Составить уравнение реакции.
20.14. Можно ли получить хром восстановлением Cr2O3 водородом с образованием водяного пара при стандартном состоянии всех веществ? Ответ обосновать, рассчитав Δ G° реакции
Cr2O3 + 3Н2 = 3Н2O (г) + 2Cr.
( = –1050 кДж/моль;
= –1050 кДж/моль; 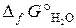 = –228,6 кДж/моль).
= –228,6 кДж/моль).
20.15. Закончить уравнения реакций: а) Na2CrO4 + H2SO4 = …;
б) Na2Cr2O7 + NaOH = …; в) Na2Cr2O7 + HCl = …; г) Cr + HCl = ….
20.16. Закончить уравнения реакций окисления соединений хрома (III):
а) Cr2O3 + NaNO3 + Na2CO3 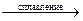 …; б) Cr(NO3)3 + NaBiO3+ HNO3 = ….
…; б) Cr(NO3)3 + NaBiO3+ HNO3 = ….
20.17. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции
2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
20.18. Закончить уравнения реакций:
а) Cr2O3 + H2SO4 = …; б) Cr2O3 + КОН 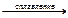 …;
…;
в) Cr2O3 + КОН + KMnO4 = …
20.19. Предложить 4 способа получения Cr2O3 Составить соответствующие уравнения реакций.
20.20. Какая масса дихромата калия требуется для приготовления 2 л 0,1 н. (по отношению к реакциям окисления в кислой среде) раствора K2Cr2O7?
(Ответ: 9,8 г).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 582; Нарушение авторских прав?; Мы поможем в написании вашей работы!