
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Железо, кобальт, никель
|
|
|
|
Лабораторная работа 22
Железо, кобальт, никель
Цель работы: изучить химические свойства соединений железа, кобальта, никеля.
Задание: получить гидроксиды железа (II), кобальта (II), никеля (II) и изучить их окислительно-восстановительные свойства; убедиться на опытах, что соединения железа (II) проявляют восстановительные, а железа (III) – окислительные свойства; получить комплексные соединения никеля и кобальта. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Железо, кобальт, никель составляют первую триаду элементов VIII группы побочной подгруппы (семейство железа), расположены в 4 периоде, относятся к d - элементам. Электронное строение 3dn4s2 (n = 6, 7, 8). Степени окисления + 2, +3 и +6 (для Fe).
В ряду напряжений Fe, Co, Ni располагаются перед водородом в той же последовательности, в какой они стоят в периодической системе элементов.
В соляной и разбавленной серной кислоте железо, кобальт, никель растворяются при комнатной температуре с выделением водорода и образованием солей М (II).
Под действием концентрированной H2SO4 и дымящей HNO3 при обычной температуре эти металлы пассивируются. Разбавленная азотная кислота растворяет железо с образованием соли Fe (II); продуктами восстановления HNO3 могут быть (в зависимости от концентрации) NH4NO3, N2, N2O: Только концентрированная HNO3 при нагревании растворяет железо с образованием солей
Fe (III).
4Fe + 10HNO3 = 4Fe(NO3)2 + NH4NO3 + 3H2O;
5Fe + 12HNO3 = 5Fe(NO3)2 + N2 + 6H2O;
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 6H2O.
Кобальт и никель растворяются в HNO3 с образованием солей М (II) и выделением NO2 в случае концентрированной кислоты и NO в случае разбавленного раствора.
Fe, Co, Ni образуют оксиды MО, M2O3 и М3О4 (МО . М2О3).
Оксид железа Fe+6O3, в свободном состоянии не получен, известны соответствующие соли − ферраты Na2FeO4, K2FeO4.
Оксиды МО и соответствующие им гидроксиды М(ОН)2 обладают основными свойствами, практически не растворимы в воде и растворяются только в кислотах. М(ОН)2 получаются при взаимодействии солей М (II) со щелочами. Гидроксид Fe(OH)2 легко окисляется и частично переходит в Fe(OH)3:
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3.
Гидроксид Со(ОН)2 существует в виде двух модификаций − синей и розовой, окисляется в Со(ОН)3 под воздействием кислорода воздуха, но медленнее, чем Fe(OH)2. Под действием окислителей Н2О2, Br2 окисление идет гораздо быстрее. В отличие от Fe(OH)2 и Со(ОН)2 гидроксид Ni(OH)2 устойчив на воздухе и устойчив к действию Н2О2. Окисляется только более энергичными окислителями (Cl2, Br2):
2Ni(OH)2 + Br2 + 2NaOH = 2Ni(OH)3 + 2NaBr.
Оксид Fe2O3 и соответствующий гидроксид проявляют основные свойства, легко растворяются в кислотах, но могут проявлять и слабые амфотерные свойства. При сплавлении со щелочами или содой образуют ферриты:
Fe2O3 + Na2CО3 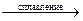 2NaFeO2 + CО2.
2NaFeO2 + CО2.
Оксиды Co2O3 и Ni2O3 и соответствующие им гидроксиды Со(ОН)3 и Ni(OH)3 плохо растворимы в воде, проявляют только основные свойства, являются сильными окислителями. При действии на них кислот образуют соли
М (II) и продкуты окисления, например:
Cо2O3 + 6HCl = 2CoCl2 + Cl2 + 3H2O;
Для железа более устойчивыми являются соединения со степенью окисления + 3, для никеля и кобальта + 2. Поэтому Fe2+ является довольно сильным восстановителем, тогда как Со2+ и Ni2 + этими свойствами в заметной степени не обладают. В степени окисления + 3 железо, кобальт и никель проявляют окислительные свойства; окислительная способность увеличивается в ряду
Fe −Co − Ni.
Соли сильных кислот, как правило, все хорошо растворимы, растворы их вследствие гидролиза имеют кислую среду.
Элементы триады железа легко образуют комплексные соединения, в которых железо может иметь степень окисления +2, +3, кобальт, главным образом, +3, а никель +2. Наиболее характерное координационное число 6, редко 4.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 788; Нарушение авторских прав?; Мы поможем в написании вашей работы!