
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение дисперсных систем за счет конденсационных процессов
|
|
|
|
К конденсационным методам получения дисперсных систем относятся конденсация, десублимация и кристаллизация. Они основаны на образовании новой фазы в условиях пересыщенного состояния вещества в газовой или жидкой среде. При этом система из гомогенной переходит в гетерогенную. Конденсация и десублимация характерны для газовой, а кристаллизация — для жидкой среды.
Необходимым условием конденсации и кристаллизации является пересыщение и неравномерное распределение вещества в дисперсионной среде (флуктуация концентрации), а также образование центров конденсации или зародышей.
Степень пересыщения β для раствора и пара можно выразить следующим образом:
βж= с/сs, βП= р/рs, (12.6)
где р, с — давление пересыщенного пара и концентрация вещества в пересыщенном растворе; рs— равновесное давление насыщенного пара над плоской поверхностью; сs— равновесная концентрация, соответствующая образованию новой фазы.
Для осуществления кристаллизации охлаждают раствор или газовую смесь.
Так, например, в результате резкого охлаждения из сиропа получают помадные конфетные массы. Кристаллизация из пересыщенного раствора сахарозы лежит в основе сахарного производства, причем степень пересыщения βжсоставляет 1,11—1,12. В процессе получения мороженого кристаллизация сообщает продукту необходимые свойства и товарный вид.
Облака относятся к дисперсным системам типа Т, Ж/Г и представляют собой взвешенные в воздушной среде капли и кристаллы воды. Образование капель в облаках происходит в результате конденсации паров, когда молекулы воды укрупняются до размеров частиц дисперсных систем. Для возникновения облаков необходимо, чтобы степень пересьщения превышала единицу. Это достигается при снижении температуры воздуха, которое приводит к уменьшению рs, а также за счет притока испарившейся воды, что приводит к увеличению р.
Конденсации водяных паров и образованию капель способствуют мельчайшие частички, находящиеся в воздухе и являющиеся ядрами конденсации. В качестве ядер конденсации могут служить: продукты сгорания топлива самолетов и ракет; частицы почвы; брызги, содержащие соли; выбросы промышленных предприятий и другие мелкие частички.
Интенсификация процесса конденсации в присутствии ядер конденсации непосредственно вытекает из уравнения Кельвина — см. формулы (2.26) и (6.11). Давление насыщенного пара определяется кривизной поверхности частиц, образующих ядра конденсации. Чем выше кривизна и меньше размер этих частиц, тем выше отношение парциального давления насыщенного пара над искривленной поверхностью р к равновесному давлению над плоской поверхностью рS. В соответствии с условием (12.6) это означает увеличение степени пересыщения на поверхности частичек, т.е. при наличии ядер конденсации. В отсутствие ядер конденсации образование капель может происходить при степени пресыщения, достигающей четырех.

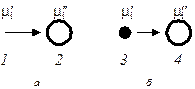 Когда ядра конденсации отсутствуют, то капли могут существовать в переохлажденном состоянии — при температуре ниже 273 К. При конденсации паров в этих условиях будут образовываться не капли, а сразу кристаллики воды, из которых формируются облака. Процесс перехода газообразного вещества в твердое, минуя жидкое, состояние называют десублимацией. Нетрудно догадаться, что десублимация — процесс, обратный сублимации. Сублимацией называют переход твердого вещества в газообразное состояние, минуя жидкое. Типичным примером этого процесса может служить сублимационная сушка ягод и плодов, способствующая их хранению. Влага, находящаяся в продуктах, замерзает, а затем в твердом состоянии испаряется; при этом сохраняются питательные и вкусовые качества продукта. Десублимация относится к конденсационным методам получения дисперсных систем.
Когда ядра конденсации отсутствуют, то капли могут существовать в переохлажденном состоянии — при температуре ниже 273 К. При конденсации паров в этих условиях будут образовываться не капли, а сразу кристаллики воды, из которых формируются облака. Процесс перехода газообразного вещества в твердое, минуя жидкое, состояние называют десублимацией. Нетрудно догадаться, что десублимация — процесс, обратный сублимации. Сублимацией называют переход твердого вещества в газообразное состояние, минуя жидкое. Типичным примером этого процесса может служить сублимационная сушка ягод и плодов, способствующая их хранению. Влага, находящаяся в продуктах, замерзает, а затем в твердом состоянии испаряется; при этом сохраняются питательные и вкусовые качества продукта. Десублимация относится к конденсационным методам получения дисперсных систем.
Таким образом, в основе конденсационных методов получение дисперсных систем лежат процессы кристаллизации, десублимации и конденсации, которые вызваны уменьшением энергии Гиббса (ΔG < 0) и протекают самопроизвольно.
При зарождении и образовании частиц из пересыщенного раствора или газовой среды изменяется химический потенциал m, возникает поверхность раздела фаз, которая становится носителем избыточной свободной поверхностной энергии.
Работа, затрачиваемая на образование частиц, определяется поверхностным натяжением s и равна
W1= 4πr2σ, (12.7)
где 4πr2— поверхность сферических частиц радиусом r.
Химический потенциал изменяется следующим образом
Δμ = μi// – μi/ < 0; μi// > μi/, (12.8)
где μi/ и μi// — химические потенциалы в соответствии с рис. 12.5.
Изменение химического потенциала характеризует перенос определенного числа молей вещества из одной фазы в другую; это число n молей равно объему частицы 4πr3/3, деленному на мольный объем Vм
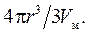 (12.9)
(12.9)
C учетом формул (12.7)—(12.9) работа образования новой поверхности в процессе конденсации Wкравна
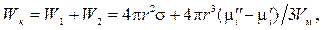 (12.10)
(12.10)
где W1и W2— соответственно работа, затрачиваемая на образование поверхности частиц, и работа на перенос вещества из гомогенной среды в гетерогенную.
Условие (12.8) означает, что образование новой фазы одним из конденсационных методов возможно в том случае, когда химический потенциал какого-либо компонента в гомогенной системе будет превышать его после образования гетерогенной системы в результате перехода компонента в другую фазу. Применительно к кристаллизации сахара μi/, — химический потенциал в растворе сахарозы, а μi// — в кристаллах сахара. Для облаков μi/ характеризует химический потенциал паров воды, а μi// — капель или льда при кристаллизации или десублимации соответственно.
Образование дисперсных систем может происходить в результате физической и химической конденсации, а также при замене растворителя.
Физическая конденсация осуществляется при понижении температуры газовой среды, содержащей пары различных веществ. При выполнении условий (12.6) и (12.8) образуются частицы или капли дисперсной фазы. Подобный процесс имеет место не только в объеме газа, но и на охлажденной твердой поверхности, которую помещают в более теплую газовую среду.
В соответствии с условием (12.8) конденсация определяется разностью химических потенциалов (μi// – μi/) < 0, которая изменяется в результате замены растворителя. В отличие от обычной физической конденсации при замене растворителя состав и свойства дисперсионной среды не остаются постоянными. Если спиртовые или ацетоновые растворы серы, фосфора, канифоли и некоторых других органических веществ влить в воду, то раствор становится пересыщенным, происходит конденсация и образуются частицы дисперсной фазы. Метод замены растворителя является одним из немногих, при помощи которых можно получить золи.
При химической конденсации происходит образование вещества с одновременным его пересыщением и конденсацией. Этот процесс можно показать на примере взаимодействия газообразного аммиака и хлористого водорода: NH3(г) + HCl(г)→ NH4Cl (ж). Образующийся газообразный хлорид аммония, давление пара которого соответствует пересыщению, согласно условию (12.6) конденсируется и превращается в капли жидкой дисперсной фазы.
В жидкой среде продукты некоторых реакций окисления, гидролиза и ряда других формируют пересыщенные растворы с одновременным выделением твердой дисперсной фазы. Характерным примером подобных реакций являются ржавые отложения в некоторых почвах и красно-коричневая окраска природных вод. Это происходит в результате окисления и гидролиза гидрокарбоната железа, растворенного в воде: 4Fe(HCO3)2+О2+H2O → 4Fe(OH)3+8CO2↑. Образующаяся соль гидроксида железа формирует частицы и определяет окраску этих растворов.
К конденсационным методам образования дисперсных систем следует отнести изотермическую перегонку, связанную с уменьшением размеров мелких капель до их полного исчезновения и ростом более крупных капель. Согласно соотношению (2.25) приращение энергии Гиббса увеличивается с уменьшением размеров частиц. Это означает, что химический потенциал как частное производное от изменения энергии Гиббса по числу молей соответствующего компонента [см. формулу (2.8)] для мелких капель будет больше, чем для крупных капель (см. рис. 12.5, б: на рис. μi/ соответствует мелким, а μi// — крупным каплям), т.е.
μi/ > μi//. (12.11)
Условие (12.11) аналогично условию (12.8) с той лишь разницей, что в них значения химического потенциала имеют неодинаковый физический смысл. Идентичность этих условий по форме свидетельствует об универсальности химического потенциала как фактора интенсивности любого физико-химического процесса.
Возможность изотермической перегонки следует также из тех процессов, которые характеризуют давление насыщенного пара над выпуклой поверхностью [см. рис. 2.6, формулу (2.26)]. Давление насыщенных паров, а следовательно и их концентрация над мелкими каплями будут значительно больше по сравнению с давлением и концентрацией паров над крупными. Избыток паров будет перемещаться в сторону крупных капель и конденсироваться на них. Пополнение пара над мелкими каплями происходит в результате их дальнейшего испарения вплоть до окончательного исчезновения. По этой причине изотермическая перегонка является разновидностью конденсационных методов.
В заключение отметим, что в отличие от диспергирования конденсационные методы позволяют получать дисперсные системы, состоящие из мелких частиц дисперсной фазы. Поэтому высокодисперсные системы, в том числе и коллоидные растворы, чаще получают методами конденсации.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1268; Нарушение авторских прав?; Мы поможем в написании вашей работы!