
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения координационной теории
|
|
|
|
Соли.
 Соли являются одним из наиболее емких по числу химических соединений классов неорганических соединений. Они образуются в результате самых разнообразных химических процессов и, в частности, являются продуктами кислотно-основных реакций взаимодействия основных и кислотных бинарных ЭnXm и полиэлементных химических соединений, характеризующихся соответственно преимущественно ионным и ковалентным характером химической связи Э-Х (табл. 1.5).
Соли являются одним из наиболее емких по числу химических соединений классов неорганических соединений. Они образуются в результате самых разнообразных химических процессов и, в частности, являются продуктами кислотно-основных реакций взаимодействия основных и кислотных бинарных ЭnXm и полиэлементных химических соединений, характеризующихся соответственно преимущественно ионным и ковалентным характером химической связи Э-Х (табл. 1.5).
Таблица 1.5. Кислотно-основные реакции солеобразования.
| Соединения | Реакция солеобразования | |
| Основные | Кислотные | |
| NaF | PF5 | NaF + PF5 = Na[PF6] |
| Na2O | P2O5 | 3Na2O + P2O5 = 2Na3[PO4] Na2O + P2O5 = 2Na[PO3] |
| Na2S | P2S5 | 3Na2S + P2S5 = 2Na3[PS4] Na2S + P2S5 = 2Na[PS3] |
| Na3N | P3N5 | Na3N + P3N5 = Na4[PN3] |
| NaH | AlH3 | NaH + AlH3 = Na[AlH4] |
| NaOH | Al(OH)3 | NaOH + Al(OH)3 = Na[Al(OH)4] NaOH + Al(OH)3 = Na[AlO2] + H2O |
| NaNO3 | I(NO3) | NaNO3 + I(NO3) = Na[I(NO3)2] |
| NaOH | HNO3 | NaOH + HNO3 = Na[NO3] + H2O |
| Al(OH)3 | H3PO4 | Al(OH)3 + H3PO4 = Al[PO4] + 6H2O 2Al(OH)3 + 3H3PO4 = Al2[HPO4]3 + 6H2O Al(OH)3 + 3H3PO4 = Al[H2PO4]3 +3H2O 3Al(OH)3 + 2H3PO4 = (AlOH)3[PO4]2 + 6H2O 3Al(OH)3 + H3PO4 = {Al(OH)2}3[PO4] + 3H2O |
| NaOH + Ba(OH)2 | H3PO4 | NaOH + Ba(OH)2 + H3PO4 = (NaBa)[PO4] + 3H2O |
| Al(OH)3 | H2SO4+ HNO3 | Al(OH)3 + H2SO4 + HNO3 = Al[(SO4)NO3] + H2O |
В составе солей можно выделить катионную и анионную составляющие, являющиеся производными исходных основных и кислотных соединений и имеющих преимущественно ионный характер химической связи. Вследствие этого в расплавах и растворах соли подвергаются процессу электролитической диссоциации, приводящей к образованию катионов и анионов.
В зависимости от состава соли классифицируются по природе катионов и анионов:
- соли со сложными катионами на основе двух разных ионов металла или иона аммония и металла ({(KAl)[SO4]2, {(NH4)2Fe}[SO4]2) называются двойными солями, а соли со сложными анионами (Ca[(ClO)Cl], Fe[(SO4)NO3]) – смешанными солями:
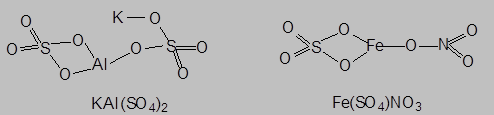 |
- в зависимости от того, анионы каких кислот входят в состав соли, выделяют: соли оксокислот и бескислородных кислот (Na2SO4 и Na2S), а также соли различных замещенных оксокислот (Na2S2O8, Na2SO3S, NaSO3Cl и т.д.):
 |
- cоли, в состав катионов которых входят гидроксидные группировки (Al(OH)[SO4], {Al(OH)}2[SO4], Al(OH)2Cl) и способные проявлять основные свойства за счет образования OH--ионов в результате процесса электролитической диссоциации катиона – например:
Al(OH)SO4®Al(OH)2+ + SO42-
Al(OH)2+ Û Al3+ + OH-
называются основными. Такие соли могут быть рассмотрены как продукты частичного замещения гидроксидных групп в основных гидроксидах на группировки, являющиеся кислотными остатками соответствующих оксо- или бескислородных кислот:
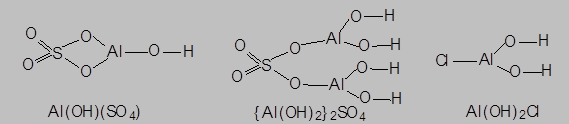 |
- соли, анионы которых содержат атомы водорода ((NH4)[HSO4], NaHS) и способны проявлять кислотные свойства за счет образования ионов гидроксония при электролитической диссоциации аниона – например:
NaHS® Na+ + HS-, HS- Û H+ + S2-
называются кислыми. Такие соли могут быть рассмотрены как продукты частичного замещения водорода в кислотах на катионы металла или аммония:
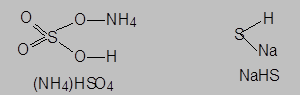
- соли, являющиеся продуктами полного замещения гидроксидных групп на кислотные остатки или атомов водорода на катионы металла (аммония), называются средними или нормальными.
Некоторые соли при кристаллизации из водных растворов образуют кристаллические решетки, содержащие молекулы воды – например: CuSO4×5H2O, Na2SO4×10H2O. Такие соли называются кристаллогидратами.
Как видно из табл. 1.5, кислые и основные соли образуются в результате реакций нейтрализации при различных соотношениях многосновных кислот и многокислотных оснований и легко переходят как друг в друга, так и в средние соли: Al(H2PO4)3 + Al(OH)3 = Al2(HPO4)3 + 3H2O
Al2(HPO4)3 + Al(OH)3 = 3AlPO4 + 3H2O
2AlPO4 + Al(OH)3 = (AlOH)3(PO4)2
(AlOH)3(PO4)2 + 3Al(OH)3 = 2{Al(OH)2}3PO4
{Al(OH)2}3PO4 + H3PO4 = (AlOH)3(PO4)2 + 3H2O
(AlOH)3(PO4)2 + H3PO4 = 3AlPO4 + 3H2O
2AlPO4 + H3PO4 = Al2(HPO4)3
Al2(HPO4)3 + H3PO4 = 2Al(H2PO4)3
Систематические названия средних солей бескислородных солей образуют по общим правилам для бинарных соединений:
Na2S - сульф ид натрия, FeCl3 - хлор ид железа (III) (трихлорид железа),
Cu(CN)2 - циан ид меди (II), AgCNS - тиоцианат серебра.
Систематические названия солей оксокислот и их производных образуются по правилам номенклатуры для комплексных соединений, которые будут рассмотрены далее. В то же время, как и для кислот, в химической практике для наиболее распространенных солей оксокислот широко используют традиционные названия.
Традиционные названия солей состоят из названий анионов и катионов. Название анионов средних солей распространенных оксокислот строится из корней русских или латинских (Табл. 1.) названий кислотообразующих элементов с соответствующими окончаниями и приставками в зависимости от их степени окисления (Табл. 6, 7) и через дефис групповым словом –ион. Для р-элементов III-VI группы в высшей степени окисления в названии анионов используют окончание –ат, в более низкой степени (N-2) – суффикс –ит и для N+ и P+ - пристаку гипо- и окончание –ит.
Для галогенов в степени окисления +7 в названии анионов используют приставку пер- и окончание –ат; для степеней окисления: +5 – окончание - ат, +3 – окончание –ит и для наиболее низкой +1 – приставку гипо- и окончание –ит.
Различные приставки: мета-, орто-, ди-, три- и т.д., используемые в названии оксокислот для указания их формы, сохраняются и в названиях анионов.
Для оксоанионов образованных d-элементами в основном используются систематические названия и только для ограниченного круга анионов (Табл. I-5.) в химической практике применяют традиционные названия.
В целом, традиционное название средних солей оксокислот строится из названия аниона (групповое слово –ион опускается) и русского названия катиона в родительном падеже с указанием римскими цифрами в круглых скобках его степени окисления (если она может быть переменной):
Fe2(S2O7) - дисульфат железа (III), Na3PO4 - ортофосфат натрия,
Ba5(IO6) - ортопериодат бария, NiSeO3 - селенит никеля (II),
NaPH2O2 - гипофосфит натрия, KMnO4 - перманганат калия.
Таблица 6. Традиционные названия оксоанионов p-элементов III-VI групп.
| N | Эz+ | Приставка/окончание | Анион, название-ион |
| Высшая степень окисления N | |||
| VI | S6+ | /-ат | SO42- сульф ат -, S2O72- дисульф ат - |
| Se6+ | SeO42- селен ат - | ||
| Te6+ | TeO42- метателлур ат -, TeO66- ортотеллур ат - | ||
| V | N5+ | NO3- нитр ат - | |
| P5+ | PO43- ортофосф ат -, PO3- метафосф ат -, P2O74- дифосф ат - | ||
| As5+ | AsO43- ортоарсен ат -, AsO3- метаарсен ат - | ||
| Sb5+ | SbO43- ортоантимон ат - | ||
| Bi5+ | BiO3- висмут ат - | ||
| IV | C4+ | CO32- карбон ат - | |
| Si4+ | SiO32- силик ат - | ||
| Ge4+ | GeO32- герман ат - | ||
| Sn4+ | SnO32- станн ат - | ||
| Pb4+ | PbO44- ортоплюмб ат -, PbO32- метаплюмб ат - | ||
| III | B3+ | BO33- ортобор ат -, BO2- метабор ат -, B2O74- дибор ат - | |
| Al3+ | AlO2- метаалюмин ат - | ||
| Степень окисления N-2 | |||
| VI | S4+ | /-ит | SO32- сульф ит -, S2O52- дисульф ит - |
| Se4+ | SeO32- селен ит - | ||
| Te4+ | TeO32- теллур ит - | ||
| V | N3+ | NO2- нитр ит - | |
| P3+ | PHO32- фосф ит - (фосфонат-) | ||
| As3+ | AsO33- ортоарсен ит -, AsO2- метаарсен ит - | ||
| Sb3+ | SbO33- ортоантимон ит -, SbO2- метаантимон ит - | ||
| Степень окисления N-4 | |||
| V | N+ | Гипо-/-ит | N2O22- гипо нитр ит - |
| P+ | PH2O2- гипо фосф ит - (фосфинат-) | ||
Таблица 7. Традиционные названия оксоанионов p-элементов VII группы.
| Приставка/окончание | Анион, название-ион |
| Высшая степень окисления +7 | |
| Пер-/ат- | ClO4- пер хлор ат -, BrO4- пер бром ат -, IO65- орто пер иод ат -, IO4- мета пер иод ат |
| Степень окисления +5 | |
| -/ат- | ClO3- хлор ат -, BrO3- бром ат -, IO3- иод ат - |
| Степень окисления +3 | |
| -/ит- | ClO2- хлор ит -, BrO2- бром ит -, IO2- иод ит - |
| Степень окисления +1 | |
| Гипо-/ит- | ClO- гипо хлор ит -, BrO- гипо бром ит -, IO- гипо иод ит - |
Таблица 8. Традиционные названия оксоанионов d-элементов.
| Группа | Элемент | Анион, название-ион |
| III | Sc3+ | ScO2- сканди ат - |
| IV | Ti4+, Zr4+, Hf4+ | TiO44- ортотитан ат -, TiO32- метатитан ат -, ZrO44- ортоцирконат ат -, ZrO32- мециркон ат -, HfO44- ортогафни ат -, HfO32- мегафни ат - |
| V | V5+, Nb5+, Ta5+ | VO3- ванад ат -, NbO3- ниоб ат -, TaO3- тантал ат - |
| VI | Cr6+, Mo6+, W6+ | CrO42- хром ат -, Cr2O72- дихром ат -, MoO42- молибд ат -, WO42- вольфрам ат - |
| Cr3+ | CrO2- хром ит - | |
| VII | Mn+7, Tc7+, Re7+ | MnO4- пер манган ат -, TcO4- пер техне ат -, ReO4- пер рен ат - |
| Mn6+ | MnO42- манган ат - | |
| Mn4+ | MnO44- ортоманган ит -, MnO32- метаманган ит - | |
| VIII | Fe6+, Ru6+ | FeO42- ферр ат -, RuO42- рутен ат - |
| Fe3+ | FeO2- ферр ит - | |
| I | Сu3+ | СuO2- купр ат - |
| II | Zn2+ | ZnO22- цинк ат - |
При традиционном названии двойных и смешанных солей, входящие в их состав катионы и анионы последовательно перечисляются:
KAl(SO4)2 - сульфат алюминия-калия, Сa(ClO)Cl - хлорид-гипохлорит кальция.
Тривиальные названия солей, используемые в технической литературе, приведены в приложении 2.
Традиционные названия солей замещенных оксокислот содержат специальные приставки, указывающие природу замещающей группировки:
- пероксо- для солей пероксокислот (NaSO3(O2) - пероксосульфат натрия, BaS2O6(O2) - пероксодисульфат бария);
- тио- для солей тиокислот (K3PO3S - тиофосфат калия, BaSO3S - тиосульфат бария, Na3PO2S2 - дитиофосфат натрия, Na3PS4 - тетратиофосфат натрия);
- галогено-, амидо-, имидо-, селено- и т.д. для соответствующих солей замещенных кислот (ZnSeO2F2 - дифтороселенат цинка, Na2PO3(NH2) - амидофосфат натрия, Na4P2O6(NH) - имидодифосфат натрия, Na3PO3Se - селенофосфат натрия);
- исторически в названии солей замещенной серной кислоты (как и для самих кислот) после приставки используют групповое название –сульфонат (KSO3Cl - хлорсульфонат калия, Ba(SO3F)2 - фторсульфонат бария, NaSO3(NH2) - амидосульфонат натрия);
- в традиционных названиях солей политионовых кислот используют групповое название -тионат c указанием числовыми приставками количества атомов серы (Na2S2O6 - дитионат натрия, (NH4)2S4O6 - тетратионат аммония).
Кислые соли – традиционные названия кислых солей образуются из названий соответствующих средних солей с добавлением к названию аниона приставки гидро - и числительного ди-, три-, тетра- и т.д., указывающего число незамещенных атомов водорода в кислотном остатке:
KHSO3 - гидро сульфит калия, Fe(H2P2O7) - дигидро дифосфат железа (II), NaH4IO6 - тетрагидро периодат натрия, Ca(HS)2 - гидро сульфид кальция. Следует отметить, что, несмотря на наличие в составе солей фосфористой H2PHO3 и фосфорноватистой HPH2O2 кислот атомов водорода – Na2PHO3, NaPH2O2, данные соли являются средними (фосфит и гипофосфит натрия), поскольку оставшиеся атомы водорода не замещаются на катионы металла или аммония.
Основные соли – традиционные названия основных солей также образуют из названий средних солей с добавлением к названию аниона приставки гидроксо- и числительного ди-, три- и т.д., указывающего число незамещенных гидроксидных группировок в соответствующем основном гидроксиде: (FeOH)NO3 - гидроксо нитрат железа (II), {Al(OH)2}3AsO4 - дигидроксо арсенат алюминия, (BaOH)Cl - гидроксо хлорид бария.
Основные соли, содержащие две незамещенные гидроксидные группировки могут подвергаться (подобно мнокислотным основным гидроксидам) процессу дегидратации с образованием солей, содержащих оксокатионы:
 |
Такие соли рекомендуется называть по типу соединений, содержащих оксидные O2—ионы – например: SbOCl хлорид-оксид сурьмы, BiO(NO3) нитрат-оксид висмута, UO2SO4 сульфат-диоксид урана. Однако традиционно такие соединения часто рассматривают как соли, содержащие оксокатионы металлов, которые называют добавляя окончание –ил к русскому или латинскому (Табл. I-1.) названию металла: SbO+ - антимонил (стибил), BiO+ - висмутил, CrO+ - хромил, UO22+ - уранил. Вследствие этого в химической практике такие соли часто называют по типу средних солей, используя соответствующие названия оксокатионов:
SbOCl - хлорид антимонила, BiO(NO3) - нитрат висмутила,
UO2SO4 - сульфат уранила.
Кристаллогидраты солей – названия кристаллогидратов солей состоят из группового слова гидрат с приставкой ди, три, тетра и т.д., указывающей число молекул воды в составе соли, и традиционного или систематического названия соли: Pb(BrO3)2×H2O - гидрат бромата свинца (II), Mn(H2PO4)2×2H2O - дигидрат дигидрофосфата марганца (II), Na2CO3×10H2O - декагидрат карбоната натрия.
 Упражнения:
Упражнения:
50.Приведите традиционные названия средних оксосолей: FeSO4, Fe2(S2O7)3, CoSO3, K2TeO4, Na6TeO6, Hg2(NO3)2, CsNO2, Ca3(PO4)2, Mg2P4O7, NiBr2, CaPHO3, LiPH2O2, K2CO3, Na3BO3, PbPbO3 (Pb2O3), Pb2PbO4 (Pb3O4), KBO2, (CH3COO)2Pb, Na2B4O7, K2ZnO2, Na2CrO4, K2Cr2O7, Fe2FeO4 (Fe3O4), KMnO4, K2MnO4, LiClO4, NaClO3, Mg(ClO2)2, KClO.
51.* Приведите традиционные названия солей замещенных оксокислот: K2S2O8, Na2S2O3, Mg(SO3Cl)2, K2SeO2F2, K2SO3Br, Na3PS4.
52. Приведите молекулярные и графические формулы средних солей: пербромат калия, перхлорат магния, метапериодат цезия, перманганат калия, хлорит кальция, нитрит лития, бериллат натрия, бромид железа(II), дихромат аммония, ацетат натрия, манганат цезия, ортоарсенат цинка.
53.* Приведите молекулярные и графические формулы солей замещенных кислот: фторсульфонат натрия, тритиокарбонат бария, тиоортофосфат калия.
54. Приведите традиционные названия кислых и основных оксосолей: Na2H2P2O7, NaH2PO4, Na2HPO4, Ca(HSO3)2, Na2H3IO6, [Al(OH)2]SO4, Fe(OH)NO2, (CuOH)2CO3.
55.Написать реакции образования Mg3(PO4)2, Ca(NO3)2 и Ba(ClO4)2 при взаимодействии: а) кислоты и основания, б) кислоты и основного оксида, в) кислотного и основного оксидов, г) кислотного оксида и основания.
56. Приведите молекулярные и графические формулы кислых и основных солей: дигидроарсенат хрома(III), гидросульфат железа(III), нитрит гидроксоалюминия, фосфит гидроксомагния.
57. Приведите традиционные названия и графические формулы солей, содержащих оксокатионы: UO2(NO3)2, (BiO)SO4, SbOClO4.
58. Приведите традиционные названия и графические формулы смешанных и двойных солей: KAl(SO4)2, Ca(ClO)Cl.
59. Приведите традиционные названия кристаллогидратов: CuSO4×5H2O, Na2B4O7×10H2O, (СrO)3AsO4×12H2O.
60. Приведите систематические названия и графические формулы солей бескислородных кислот: Fe(HS)2, Mg(OH)CN, [Al(OH)2]2Se, AsOCl.
61. Напишите уравнений реакций образования средних, кислых и основных солей в результате взаимодействия: а) гидроксида магния и угольной кислоты, б) гидроксида алюминия и ортофосфорной кислоты, в) гидроксида железа (III) и серной кислоты. Назовите продукты реакций и напишите их графические формулы.
62. Напишите уравнения реакций превращения следующих солей в средние соли, назовите исходные вещества и продукты реакций: [Al(OH)2]2SO4, KH2PO4, NiOHBr, Na2HAsO4, Cr(OH)2NO3, Ca(HCO3)2.
63. Напишите уравнения реакций, протекающих между данными веществами в растворе: Al(H2PO4)3 и Ba(OH)2, Pb(CH3COO)2 и KI, FeS и HCl, K2CrO4 и BaCl2, Fe(OH)SO4 и NaOH, CrCl3 и KOH (изб.).
64. Какие из перечисленных солей Al(OH)(NO3)2, K3PO4, NaHSO4, CH3COONH4, NiOHCl, BaClBr, KAg(NO3)2 будут взаимодействовать: а) с KOH, б) H2SO4? Напишите уравнения возможных еакций, назовите исходные вещества и продукты реакций.
65. Осуществить следующие превращения, назвать продукты реакций:
a) Zn → ZnSO4 → Zn(OH)2 → ZnOHBr → ZnBr2
↓ ↓
ZnO → Na2ZnO2 K2[Zn(OH)4] → ZnCl2 → AgCl
б) S → SO2 → SO3 → H2SO4 → NaHSO4 → Na2SO4 → BaSO4
↓ ↓ NH3∙H2O NH3∙H2O
Li2SO3 CuSO4 → (CuOH)2SO4 → [Cu(NH3)4](OH)2
в) H4P2O7 → P4O10 → Ca3(PO4)2 → CaCl2 → CaCO3 → Ca(HCO3)2
 Основы теории координационных соединений были заложены в 1893 г. А. Вернером[†]. В состав комплексного соединения входит координационный центр – центральный атом или ион, называемый комплексообразователем, и непосредственно взаимодействующие с ним (координирующиеся вокруг него) другие структурные элементы (атомы, ионы, молекулы) – лиганды [‡]. Одно из наиболее общих определений[§] гласит - «координационными называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов)”.
Основы теории координационных соединений были заложены в 1893 г. А. Вернером[†]. В состав комплексного соединения входит координационный центр – центральный атом или ион, называемый комплексообразователем, и непосредственно взаимодействующие с ним (координирующиеся вокруг него) другие структурные элементы (атомы, ионы, молекулы) – лиганды [‡]. Одно из наиболее общих определений[§] гласит - «координационными называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов)”.
Совокупность центрального атома (иона) комплексообразователя и лигандов составляет внутреннюю координационную сферу комплекса, которая и представляет собой собственно комплексную (координационную) частицу, существующую при определенных условиях как единое целое. В зависимости от соотношения зарядов координационного центра и лигандов комплексная частица может быть как нейтральной, так и положительно или отрицательно заряженной. Компенсация избыточного отрицательного или положительного заряда комплексной частицы происходит в результате ее электростатического взаимодействия с противоположно заряженными с катионами или анионами, которые образуют внешнюю сферу комплекса. Внутреннюю сферу комплекса при записи химической формулы, как правило, отделяют от внешней квадратными скобками: K4[Fe(CN)6], [Co(NH3)5Cl]Cl2, Na2[SO4], [NH4]Cl. Следует отметить, что в формулах часто встречающихся солей, кислот квадратные скобки часто опускаются. Однако с точки зрения координационной теории в этих соединениях также можно выделить внутрисферную и внешнесферную составляющие. Например, в сульфате натрия внутреннюю сферу образуют атом серы (гипотетический ион S6+) и непосредственно координированные к нему четыре эквивалентных атома кислорода (оксидных O2—иона), каждый из которых образует по одной s-связи с серой и участвует в образовании двух делокализованных по всей внутренней сфере p-связей. Суммарный отрицательный заряд комплекса [SO4]2- компенсируется двумя катионами Na+, связанными с комплексным сульфат-ионом преимущественно ионной связью.
 Принципиальным отличием внутрисферных лигандов и внешнесферных частиц комплекса является с одной стороны отсутствие непосредственного взаимодействия внешнесферных частиц с координационным центром, а с другой – различный характер химической связи: преимущественно ионный между внешнесферными частицами и комплексной частицей и ионно-ковалентный (донорно-акцепторный) характер взаимодействия между лигандами и координационным центром во внутренней сфере комплекса. Это приводит к различной эффективности процессов электролитической диссоциации комплексных соединений в водных растворах. Диссоциация комплексных соединений на внутреннюю и внешнюю сферу, называемая первичной диссоциацией, протекает практически нацело по типу сильных электролитов, а вторичная диссоциация – образование в объеме раствора гидратированных компонентов внутренней сферы комплекса по типу слабых электролитов:
Принципиальным отличием внутрисферных лигандов и внешнесферных частиц комплекса является с одной стороны отсутствие непосредственного взаимодействия внешнесферных частиц с координационным центром, а с другой – различный характер химической связи: преимущественно ионный между внешнесферными частицами и комплексной частицей и ионно-ковалентный (донорно-акцепторный) характер взаимодействия между лигандами и координационным центром во внутренней сфере комплекса. Это приводит к различной эффективности процессов электролитической диссоциации комплексных соединений в водных растворах. Диссоциация комплексных соединений на внутреннюю и внешнюю сферу, называемая первичной диссоциацией, протекает практически нацело по типу сильных электролитов, а вторичная диссоциация – образование в объеме раствора гидратированных компонентов внутренней сферы комплекса по типу слабых электролитов:
K4[Fe(CN)6] ® [Fe(CN)6]4- + 4K+
[Fe(CN)6]4- Û Fe2+ + 6CN-
Это служит одним из экспериментальных приемов установления состава внутренней и внешней сферы комплексных соединений. Например, при проведении реакции взаимодействия комплекса [Co(NH3)5Cl]Cl2 с нитратом серебра в результате обменной реакции: [Co(NH3)5Cl]Cl2 + 2AgNO3 = 2AgCl¯ + [Co(NH3)5Cl]NO3 осаждается только два хлоридных иона, что указывает на присутствие третьего иона хлора в составе внутренней сферы комплекса.
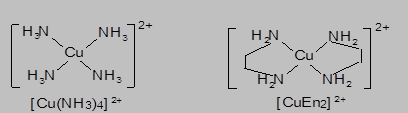 Количественный состав внутренней сферы комплекса определяется величиной координационного числа центрального атома (иона) – числом координированных лигандов. Так, в K[Ag(CN)2], Na2[CO3], [NH4]Cl, Ni(CO)4, PF5, [Co(H2O)6]Cl3 - координационные числа Ag+, C4+, N3-, Ni, P5+, Co3+ составляют: 2, 3, 4, 5 и 6. Количество связей, которые образует один лиганд с комплексообразователем, называется дентатностью лиганда. Каждый из лигандов в рассмотренных выше комплексах занимает одно координационное место. Такие лиганды называются монодентатными. В тоже время, один лиганд может занимать несколько координационных мест во внутренней сфере комплекса в результате образования нескольких донорно-акцепторных связей с координационным центром. Например, в отличие от молекулы аммиака, способной образовывать только одну донорно-акцепторную связь с участием неподеленной пары азота, этилендиамин NH2-CH2-CH2-NH2 (En) характеризуется наличием двух донорных атомов азота и может образовывать две связи с центральным ионом комплексообразователем:
Количественный состав внутренней сферы комплекса определяется величиной координационного числа центрального атома (иона) – числом координированных лигандов. Так, в K[Ag(CN)2], Na2[CO3], [NH4]Cl, Ni(CO)4, PF5, [Co(H2O)6]Cl3 - координационные числа Ag+, C4+, N3-, Ni, P5+, Co3+ составляют: 2, 3, 4, 5 и 6. Количество связей, которые образует один лиганд с комплексообразователем, называется дентатностью лиганда. Каждый из лигандов в рассмотренных выше комплексах занимает одно координационное место. Такие лиганды называются монодентатными. В тоже время, один лиганд может занимать несколько координационных мест во внутренней сфере комплекса в результате образования нескольких донорно-акцепторных связей с координационным центром. Например, в отличие от молекулы аммиака, способной образовывать только одну донорно-акцепторную связь с участием неподеленной пары азота, этилендиамин NH2-CH2-CH2-NH2 (En) характеризуется наличием двух донорных атомов азота и может образовывать две связи с центральным ионом комплексообразователем:

В результате этого каждая молекула этилендиамина занимает два координационных места во внутренней сфере комплекса. Такие лиганды, занимающие в координационной сфере центрального атома (иона) несколько координационных мест, называются полидентатными (би-, три-, тетра-, пента-, гексадентатными) лигандами. Нарядус органическими диаминами, бидентатными лигандами могут выступать и другие соединения с двумя донорными атомами:
 |
В настоящее время известны комплексы с разнообразными полидентатными лигандами, некоторые из которых представлены в табл. I-7. Полидентатные лиганды, строение которых приводит к образованию циклов при их комплексообразовании, называются хелатными [**] лигандами, а соответствующие комплексы на их основе хелатными комплексами.
Таблица 9. Полидентатные хелатные лиганды.
| Название | Дентатность | Графическая формула |
| Диметилглиоксим (DMG) | ||
| Триаминопропан | ||
| Триаминотриэтиламин | ||
| Этилендиаминтетраацетат-ион (ЭДТА) |

Полидентатные лиганды своими разными донорными атомами часто образуют с координационным металлическим центром два типа связей – донорно-акцепторные и ковалентные. Это характерно, в частности, для аминокислот и других органических соединений, содержащих одновременно атом азота и гидроксидную группу. В этом случае бидентатный лиганд образует с центральным атомом одну ковалентную связь за счет неспаренного электрона атома кислорода, остающегося после отщепления атома водорода от гидроксидной группы, а другую донорно-акцепторную связь за счет неподеленной электронной пары атома азота. Примером такого взаимодействия может служить комплекс никеля (II) c двумя молекулами диметилглиоксима, в каждой из которых происходит отщепление атома водорода только от одной гидроксидной группы. Такого рода комплексные соединения называются внутрикомплексными. Они обладают высокой устойчивостью и часто характерной яркой окраской – например, NiDMG имеет ярко-красную окраску, что определяет широкое использование внутрикомплексных соединений в аналитической практике для определения многих металлов.
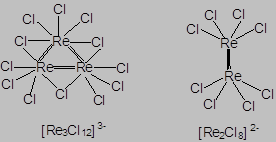
 Комплексные соединения, содержа-щие только один координационный центр, называются моноядерными, а несколько – полиядерными комплексами. Наряду с полиядерными комплексами, объединение металлических центров в которых обеспечивается мостиковыми лигандами, существует большой круг полиядерных комплексов, характеризующихся образованием прочных химических связей непосредственно между металлическими центрами. Такие комплексные соединения называются кластерными комплексами.
Комплексные соединения, содержа-щие только один координационный центр, называются моноядерными, а несколько – полиядерными комплексами. Наряду с полиядерными комплексами, объединение металлических центров в которых обеспечивается мостиковыми лигандами, существует большой круг полиядерных комплексов, характеризующихся образованием прочных химических связей непосредственно между металлическими центрами. Такие комплексные соединения называются кластерными комплексами.
В зависимости от заряда комплексы подразделяются на катионные ([Co(NH3)6]3+, [Сu(H2O)4]2+), нейтральные (Ni(CO)4, [Pt(NH3)2Cl2]), анионные ([FeCl6]3-, [Hg(CN)4]2-) и катионно-анионные ([Cr(NH3)6][Cr(CN)6], [CuEn2][Ag(CN)2]2), тогда как по природе лигандов – на смешанно-лигандные комплексы ([Cu(NH3)(H2O)Cl(NO2]) и комплексы с однородным лигандным окружением центрального атома.
Среди наиболее часто встречающихся в химической практике комплексов с однородным лигандным окружением можно выделить:
- аммиачные и аминные, содержащие во внутренней сфере молекулы аммиака и органических аминов: [Cu(NH3)4](NO3)2, [Ni(En)2]Br2;
- аква-, гидроксо- и оксокомплексы, в качестве лигандов у которых выступают молекулы воды и продукты их кислотной диссоциации – гидроксидные ОН- и оксидные О2--ионы:
[Zn(H2O)4]2+ Û [Zn(OH)4]2- + 4H+
[Zn(OH)4]2- Û [ZnO2]2- + 2H2O;
-ацидокомплексы, содержащие во внутренней сфере разнообразные кислотные остатки: [NiCl4]2-, [HgBr4]2-, [TiF6]2-, [Co(NO2)6]3-, [Pd(CN)4]2-, [Fe(NCS)6]2-.
Изомерия в комплексных соединениях. Сложное многокомпонентное строение комплексных соединений приводит к существованию различных изомерных соединений с одинаковой простейшей эмпирической формулой, но разным строением и свойствами. Среди характерных для комплексов типов изомерии можно отметить:
- координационную изомерию - различное распределение лигандов между двумя комплексообразователями в катионно-анионных комплексах:
[Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6];
- координационную полимерию – комплексные соединения одного эмпирического состава, но разной молекулярной массы:
[Pt(NH3)4][PtCl4] и [Pt(NH3)4][Pt(NH3)Cl3]2;
- ионизационную изомерию (ионизационную метамерию) – комплексы с различным распределением лигандов между внутренней и внешней сферой:
[Co(NH3)5SO4]Cl и [Co(NH3)5Cl]SO4;
- гидратную изомерию, которая является частным случаем ионизационной изомерии и связана с различным распределением молекул воды между внутренней и внешней сферой: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2×H2O, [Cr(H2O)4Cl2]Cl×2H2O, [Cr(H2O)3Cl3]×3H2O;
- связевую изомерию – координация амбидентатных лигандов к координационному центру различными донорными атомами:
Na2[Pt(NO2)6] и Na2[Pt(NO2)5(ONO)];
- изомерию лигандов (конформационную изомерию) – наличие в составе комплексов изомеров многоатомных лигандов. Например, органический диамин общей формулы C3H6(NH2)2 может существовать в виде 1,2-диаминопропана (pn) и 1,3-диаминопропана (tn). Это приводит к образованию на их основе изомерных комплексов:
[Cu(pn)2]Cl2 и [Cu(tn)2]Cl2;
- геометрическую изомерию – различное пространственное расположение лигандов во внутренней сфере комплексов. Наиболее часто встречающимся типом этой изомерии является цис-транс изомерия в комплексах с октаэдрическим и плоскоквадратным строением:
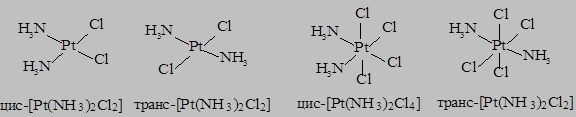
- оптическую изомерию – существование комплексов в двух зеркально-симметричных пространственных формах, называемых энантиомерами, которые обладают различной оптической активностью – вращают плоскость поляризации света в противоположных направлениях:
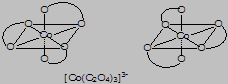
 Упражнения:
Упражнения:
66. Определите координационный центр, его заряд и координационное число, а также лиганды и их заряд в следующих соединениях: SF6, SO2Cl2, [SO4]2-, [CrO4]2-, [ZnO2]2-, [Mn(H2O)6]2+, [NiCl4]2- Ni(CO)4, [Ni(CN)4]2-, [Co(NH3)6]3+, [Al(OH)6]3-.
67. Чем отличается характер химической связи во внутренней и внешней сфере координационного соединения? Определите внутреннюю и внешнюю сферу и их заряды в следующих соединениях: Na2SO4, K2Cr2O7, Ba2[Fe(CN)6], Rb[B(OH)4], H3PO4, [UO2]Cl2, [Co(NH3)5Cl]Cl2, NH4NO3, [Cr(H2O)6][Cr(CN)6].
68. Что такое дентатность лиганда? Определите дентатность лигандов в следующих комплексных соединениях кобальта (III): Na[Co(NH3)4(CO3)2], [Co(NH3)4CO3]ClO4, Na[CoEn2(CO3)2], Na[Co(ЭДТА)], Na[Co(ЭДТА)Сl2].
69. Какие комплексы называются: моноядерными, полиядерными, хелатными, внутрикомплексными? Приведите примеры.
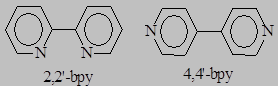 70.* Какой из гетероциклических дииминов – 2,2’-бипиридил (2,2’-bpy) или 4,4’-бипиридил (4,4’-bpy) может выступать в качестве мостикового лиганда и в качестве хелатирующего лиганда?
70.* Какой из гетероциклических дииминов – 2,2’-бипиридил (2,2’-bpy) или 4,4’-бипиридил (4,4’-bpy) может выступать в качестве мостикового лиганда и в качестве хелатирующего лиганда?
71. К какому типу комплексов (моно- или полиядерных; катионных, анионных, нейтральных или катионно-анионных; смешанно-лигандных или аква-, гидроксо-, оксо-, ацидокомплексов, аммиакатов, аминатов) относятся следующие соединения: NaPF6, SO3, Na2S2O7, H2CrO4, UO2(NO3)2, K4[Fe(CN)6], (K2[ZnO2], Ba[Al(OH)4]2, NH4Cl, [Mn(H2O)6]SO4, [Cr(H2O)3Cl3], Li2[NiCl4], Ni(CO)4, Na2[Ni(CN)4], [Co(NH3)4CO3]2(SO4), [Pt(NH3)4][PdCl4].
72. Приведите по 2 примера различных типов изомерных комплексов: геометрических, связевых, гидратных, ионизационных, координационных.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2824; Нарушение авторских прав?; Мы поможем в написании вашей работы!