
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение простейших и молекулярных формул соединений
|
|
|
|
M / M
Пример 1. Сколько молекул H2S содержится в 6,8 г сероводорода? Чему равна масса одной молекулы H2S?
Решение. Учитывая, что М (H2S) = 34 г/моль, m = 6,8 г сероводорода:
ν (H2S) = m / М(H2S) = 6,8 / 34 = 0,2 моль
Т. к. 1 моль содержит NA частиц вещества, то число молекул N (H2S):
N (H2S) = ν ∙ NA = 0,2 × 6,02×1023 = 1,2×1023
Тогда масса mм (H2S) одной молекулы H2S:
mм (H2S) = M(H2S) / NA = 34 / 6,02×1023 = 5,65×10-23 г.
В соответствии с законом Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Т.е., при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот объем называется молярным (мольным) объемом и при нормальных условиях н.у. [‡‡] [Т0 = 273 К (0 оС), Р0 = 101,325 кПа (1 атм, 760 мм.рт.ст.)] он составляет:
VМ = 22,41383±0,0070 л/моль.
Взаимосвязь между основными параметрами вещества в газовой фазе определяется уравнением Менделеева-Клапейрона:
РV = ν RT = 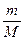 RT
RT
где R = 8,314 Дж×моль-1×К-1 – молярная газовая постоянная [§§].
Пример 2. Определить молярную массу газа, если: а) 1,5 л его при 30º С и давлении 110 кПа имеют массу 2,62 г; б) 624 мл его при 17º С и давлении 780 мм рт.ст. весят 1,56 г.
Решение. а) Выразим данные задачи в единицах СИ: R = 8,314 Дж/моль∙К, Р = 1,1∙104 Па, V = 1,5∙10-3 м3, Т = 303 К. Из уравнения Менделеева-Клапейрона находим молярную массу газа:
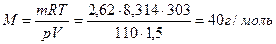
б) Т.к. Р = 780 мм рт.ст., универсальная газовая постоянная будет принимать значение R = 62,36 л∙мм рт.ст./моль∙К, V = 0,624 л, Т = 290 К. Из уравнения Менделеева-Клапейрона находим молярную массу газа:

При постоянном количестве вещества (ν = const) соотношение между тремя параметрами Р, Т и V состояния газа также постоянно:
PV/T = const (уравнение Клапейрона)
Это позволяет привести объем газа (V) измеренный при данных условиях (P, T) к нормальным условиям (P0, T0):
P0V0/T0 = PV/T, отсюда V0 = (P/P0)×(T0/T)×V
Уравнения Менделеева-Клапейрона и Клапейрона, а также величина молярного объема широко используются в химической практике для определения массы и количества моль газообразных химических соединений.
Пример 3. Определите объем, который занимают 25 г метана CH4 при 0 ºС и 101,3 кПа. Сколько молекул метана содержится в данной массе?
Решение. Т.к. объем метана измерен при нормальных условиях, то молярная масса метана, равная 16 г/моль, соответствует молярному объему – 22,4 л/моль при н.у. Определим объем 25 г CH4:
16 г CH4 занимают объем 22,4 л
25 г CH4 - х л
х = V (CH4) = 35 л.
Определим число молекул метана в данном объеме:
22,4 л CH4 содержат 6,02∙1023 молекул
35 л CH4 - у молекул
у = N (CH4) = 9,41∙1023 молекул.
Пример 4. Вычислить массу и определить количество молей сероводорода H2S, занимающего при 17 ºС и 98,64 кПа объем 1,8 л.
Решение. Объем H2S, приведенный к нормальным условиям составляет:
V0(H2S) = (P/P0)×(T0/T)×V = (98,64/101,3)×(273/290)×1,8 = 1,65 л
1 моль H2S занимает объем 22,4 л
х моль - 1,65 л
х = ν = 1,65/22,4 = 0,0737 моль
Масса H2S составляет: m = M(H2S) × ν = 34,08×0,0737 = 2,51 г.
Пример 5. Какой объем займет при 20 ºС и 250 кПа аммиак массой 51 г?
Решение. Определяем количество молей аммиака:
ν = m/M(NH3) = 51/17 = 3 моль.
Объем аммиака при нормальных условиях составит:
V0 = V0(M)× ν = 22,4×3 = 67,2 л,
а при экспериментальных условиях в соответствии с уравнением Клапейрона:
V = (Р0/P)×(T/T0)×V0 = (101,3/250)×(293/273)×67,2 = 29,2 л
Пример 6. Сколько молекул содержится в 1 мл водяного пара при 25 ºС и 3173 Па?
Решение. По уравнению Менделеева - Клапейрона определим количество молей водяного пара[***]:
ν = (pV)/(RT) = (3173×10-4)/(8,314×298) = 1,28×10-6 моль
и с помощью постоянной Авагадро - число молекул:
N = ν ×NA = 1,28×10-6×6,023×1023 = 7,71×1017 молекул.
Подобно воздуху, газы часто представляют собой смеси индивидуальных химических соединений. Для расчетов массы и числа молей индивидуального химического соединения по уравнениям Менделеева-Клапейрона и Клапейрона в этом случае используется величина не общего давления газовой смеси, а парциального давления газа конкретного химического соединения. Парциальное давление газа в газовой смеси р - это то давление, которое производил бы газ индивидуального соединения, занимая при тех же условиях объем всей газовой смеси. В соответствии с законом парциальных давлений Дальтона – общее давление смеси газов (Р), не вступающих в химическое взаимодействие, равно сумме парциальных давлений (р1, р2, р3…) ее составных частей:
Р = р1 + р2 + …рn.
Пример 7. Рассчитать парциальные давления газов в воздухе, если общее давление P = 101,3 кПа, а состав сухого воздуха в объемных процентах составляет: 78,09% N2, 20,95% О2, 0,932% Ar и 0,03% CO2.
Решение. Парциальное давление каждого газа пропорционально его объемному содержанию: p(N2) = 0,7809×101,3 = 79,1 кПа, р(О2) = 0,2095×101,3 = 21,2 кПа, р(Ar) = 9,32×10-3×101,3 = 0,94 кПа, р(СО2) = 3×10-4×101,3 = 0,304 кПа.
Важным в химической практике является случай, когда газ индивидуального химического соединения, собирают над запирающей его жидкостью, имеющей собственное давление пара, которым нельзя пренебречь. В этом случае получается газовая смесь, состоящая из газа химического соединения и паров запирающей жидкости, общее давление которой определяется суммой парциальных давлений газа и пара. В связи с этим при проведении расчетов массы и числа молей химического соединения необходимо использовать его парциальное давление (р), которое определяется разностью общего давления (Р) и парциального давления паров запирающей жидкости:
р = Р - рпара
Пример 8. Вычислить массу 70 мл кислорода, собранного над водой при 27 0С и 103,3 кПа, если давление пара воды при той же температуре составляет 1 кПа.
Решение. Определим парциальное давление кислорода в смеси с водяным паром:
р(О2) = Р – р(Н2О) = 102,3 – 1 = 102,3 кПа
Приведем объем кислорода к нормальным условиям:
V0 = (P(O2)/P0)×(T0/T)×V = (102,3/101,3)×(273/300)×0,07 = 0,0643 л
и, используя молярный объем 22,4 л, рассчитаем массу кислорода:
32 г O2 занимают объем 22,4 л
m г O2 - 0,0643 л
m = 32×0,0643/22,4 = 9,2×10-2 г.
Наряду с молярным объемом, в химической практике для характеристики химических соединений в газовой фазе используют величину относительной плотности газа (D). Как следует из закона Авогадро, в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, а следовательно и молей газов. В результате этого отношение масс равных объемов двух газов равно отношению их молярных масс:
m1 / m2 = M1 / M2
где m1 и m2 – массы двух газов одинакового объема, а М1 и М2 – их молярные массы. Отношение m1/m2 = D и называется относительной плотностьюпервого газа по второму, используемому в качестве стандарта и указываемому в нижнем индексе величины Ds. Такими стандартами обычно являются доступные в химической практике индивидуальные газы с известными молярными массами – H2 (M = 2,016 г/моль), N2 (M = 28,0134 г/моль), или воздух, являющийся смесью газов со средней молекулярной массой МВ = 28,8 г/моль[†††]. Используя величину относительной плотности газообразного химического соединения по отношению к стандарту, можно получить значение молярной массы соединения:
М = Ds×Ms
Пример 9. Относительная плотность галогеноводорода по воздуху составляет 2,81. Какой это галогеноводород? Какова его плотность по водороду?
Решение. Молярная масса галогеноводорода HHal (Hal – галоген):
M(HHal) = DB×MB = 2,81×28,8 = 80,9 г/моль
Молярная масса галогена: M(Hal) = M(HHal) – M (H) = 80,9 – 1 = 79,9 г/моль, следовательно галоген – бром, а газ – бромоводород.
Относительная плотность HBr по водороду:
DH2 = M(HBr)/M(H2) = 80,9/2 = 40,45
Важнейшей количественной характеристикой химического соединения, определяющей его состав, является простейшая химическая формула соединения, которая показывает минимальное соотношение между атомами в химическом соединении и которую обычно устанавливают по результатам «элементного анализа» соединения - массового процентного содержания (массовой доли) - ω химических элементов (или группы атомов) в соединении.
Пример 10. Рассчитать результаты элементного анализа сульфида натрия.
Решение. Один моль сульфида натрия с массой m(Na2S) = M(Na2S) = 78 г содержит один моль атомов серы с массой m(S) = M(S) = 32 г и два моля атомов натрия с массой m(Na) = 2M(Na) = 46 г. Следовательно, процентное массовое содержание натрия (Na%) и серы (S%) составляет:
ω Na% = (m(Na)/m(Na2S))×100 = 58,87%, ω S% = (m(S)/m(Na2S))×100 = 41,03%.
Пример 11. Определить массовую долю кристаллизационной воды в кристаллогидрате Na2CO3×10H2O.
Решение. Один моль кристаллогидрата с массой m = M(Na2CO3×10H2O) = 286 г содержит 10 молей кристаллизационной воды с массой m(H2O) = 10M(H2O) = 180 г. Следовательно, массовая доля кристаллизационной воды в кристаллогидрате составляет:
ω (H2O) = (m(H2O)/m) ×100= (180/286)×100 = 62,9 %.

Упражнения:
77. Определить массу одной молекулы: а) оксида серы (IV), б) сероводорода. Какой объем при н.у. занимают 9,03∙1023 молекул азота N2? Какова их масса?
78. Одинаковое ли число молекул содержится: а) в 1 л H2 и 1 л Cl2, б) в 3 г N2 и 3 г NH3, в) в 5 молях О2 и в 5 молях О3?
79. При одинаковых условиях взяты 7,5 л хлора и 2,5 л водорода. Каково численное соотношение молекул в данных объемах газов?
80. В каком объеме хлора (0 ºС, 101,3 кПа) содержится 1020 молекул? Чему равна масса этого объема хлора?
81. Сопоставьте число молекул, содержащихся в 1 г H2SO4 и 1 г HNO3?
82. Выразите в граммах массу электрона, составляющую 5,5×10-4 а.е.м.
83. Сколько молей водорода находится в баллоне объемом 25 л при 15 ºС и давлении 810, 4 кПа?
84. Масса 500 мл неизвестного газа при 87º С и давлении 96 кПа равна 0,93 г. Вычислить молярную массу газа.
85. Вычислить массу 1 мл водорода при 20º С и давлении 700 мм рт.ст.
86. В двух закрытых баллонах при 27 ºС находятся одинаковые массовые количества – в одном кислорода, а в другом азота. В каком баллоне давление больше и во сколько раз? До какой температуры следует нагреть содержимое одного из баллонов, чтобы уравнять давления газов?
87. Рассчитайте массу CO2, находящегося в закрытом баллоне при 37 ºС и давлении 202,6 кПа, если 160 г кислорода при 12 0С, находящиеся в этом же баллоне создают давление 121,6 кПа.
88. Вычислите массу 76 мл азота, собранного над водой при 29 0С и 104 кПа, если давление пара воды при той же температуре составляет 4 кПа.
89. Одинаковые объемы водорода собрали при 20 0С и общем давлении 101,3 кПа в одном случае над водой (давление паров воды при 20 0С составляет 2,3 кПа), а в другом – над ртутью. Каково соотношение между массовыми количествами водорода в этих двух случаях?
90. Плотность паров брома по воздуху 5,37. Каков состав молекулы брома?
91. Определить молекулярную формулу аллотропной модификации кислорода, если плотность этого простого вещества по оксиду углерода(II) равна 1,714.
92. Масса 2л некоторого газа при н.у. составляет 3,04 г, а масса 3 л азота равна 3,75 г. Вычислить молекулярную массу газа, исходя: а) из его плотности по азоту, б) из его молярного объема.
93. При прокаливании 2,42 г кристаллогидрата нитрата меди масса вещества уменьшилась на 1,62 г. Установить формулу кристаллогидрата.
94. Молекулярная масса сульфида некоторого р-элемента IV группы относится к молекулярной массе бромида того же элемента как 23: 87. Определить молекулярную массу и название элемента, если элемент образует сульфид и оксид в одной и той же характерной степени окисления.

Простейшая формула устанавливает количественное соотношение между атомами химических элементов, входящих в состав соединения, в соответствии с отношениями масс элементов. Для установления простейшей формулы достаточно данных элементного анализа о процентном массовом содержании элементов в соединении. Например, результаты элементного анализа ацетилена и бензола показывают, что оба соединения содержат 92,3% углерода и 7,7% водорода. С учетом относительных атомных масс углерода и водорода это указывает на подобную простейшую формулу для обоих соединений СxHy, в которой на 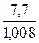 атомов водорода приходится
атомов водорода приходится 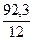 атомов углерода: x: y =
атомов углерода: x: y = 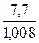 :
: 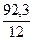 = 1: 1. Таким образом, и ацетилен и бензол характеризуются одинаковой простейшей формулой СН, указывающей, что соотношение атомов водорода и углерода в этих соединениях 1:1.
= 1: 1. Таким образом, и ацетилен и бензол характеризуются одинаковой простейшей формулой СН, указывающей, что соотношение атомов водорода и углерода в этих соединениях 1:1.
Молекулярная формула отражает действительный состав молекул химических соединений. Для определения молекулярной формулы необходимы дополнительные данные о величине молекулярной массы соединения М. Соотношение между величиной М и расчетной величиной молекулярной массы M’ соединения с простейшей формулой позволяет определить целое число n = M/M’, показывающее соотношение между количеством атомов элементов в молекулярной и простейшей формуле. Так, несмотря на одинаковую простейшую формулу СН с M’= 13 г/моль, различие в молекулярных массах ацетилена (M = 26 г/моль) и бензола (М = 78 г/моль) показывает различие в их молекулярных формулах (СН)n: n = 2 для ацетилена С2Н2 и n = 6 для бензола С6Н6.
Наряду с классическими методами определения молекулярных масс для соединений в газовой фазе - по уравнению Менделеева-Клапейрона, установления мольного объема и относительной плотности Ds газа по отношению к различным стандартам, в настоящее время существует большое разнообразие прямых и косвенных физико-химических методов определения молекулярных масс химических соединений в различных агрегатных состояниях. В рамках атомно-молекулярного учения определенную роль в установлении молекулярных масс простых веществ и атомных масс элементов сыграли: 1) метод, основанный на определении удельной теплоемкости простых веществ, и 2) метод Каницаро.
В основе метода определения атомной массы по значению удельной теплоемкости простых веществ лежит правило Дюлонга и Пти – произведение удельной теплоемкости [C, Дж/моль×К] твердого простого вещества на молярную массу его атомов есть величина постоянная и равная приблизительно 26 Дж/моль×К: С×М @ 26. В результате этого на основании данных о величине удельной теплоемкости простого вещества можно получить приближенное значение молярной массы, численно равное атомной массе элемента, образующего данное простое вещество: А = М @ 26/C.
Таблица 10. Данные элементного анализа углеродсодержащих соединений.
| Соединение | Удельная теплоемкость С, % | Молярная масса соединения, г/моль | Масса углерода в 1 моле соединения, г |
| Метиловый спирт | 37,5 | 32×0,375 = 12 | |
| Метан | 75,0 | 16×0,750 = 12 | |
| Ацетилен | 92,3 | 26×0,923 = 24 | |
| Ацетон | 62,1 | 58×0,621 = 36 | |
| Бензол | 92,3 | 78×0,923 = 72 |
Метод Каницаро основан на анализе массового содержания химического элемента в возможно большем числе соединений. Наименьшая масса элемента, приходящаяся на один моль соединения, и принимается за молярную массу данного элемента. Например, анализ содержания углерода в различных органических соединениях: показывает (табл. 1.10), что в 1 моле метилового спирта и метана на долю углерода приходится наименьшая масса 12 г. Поскольку в 1 моле углеродсодержащего соединения не может быть меньше 1 моля атомов углерода, то молярная масса углерода принимается равной 12 г/моль.
Пример 12. Определить простейшую формулу оксида хрома CrxOy, содержащего 68,4% Cr.
Решение. Атомные массы хрома и кислорода, входящих в состав оксида хрома с простейшей формулой СrxOy, равны 52 и 16. Поэтому массы хрома и кислорода в составе оксида относятся с одной стороны как 52x: 16y, а с другой – как массовые доли хрома и кислорода из условия задачи: 68,4: 31,8:
52x: 16y = 68,4: 31,8
x: y = (68,4/52): (31,8/16) = 1,32: 1,98
Для того чтобы выразить отношение x: y целыми числами, разделим оба члена отношения на меньший (1,32) и умножим на два:
x: y = (1,32/1,32): (1,98/1,32) = 1: 1,5 = 2: 3
Таким образом, простейшая формула оксида хрома - Cr2O3.
Пример 13. Найти молекулярную формулу бинарного водородного соединения азота, содержащего 12,5% водорода, если его плотность по водороду равна 16.
Решение. Используя атомные массы водорода и азота и их массовое содержание, найдем отношение числа атомов азота (х) к числу атомов водорода (у) в молекуле:
х: у = (87,5/14): (12,5/1) = 6,25: 12,5 = 1: 2.
Таким образом, простейшая формула соединения NH2 c условной молекулярной массой M’ = 16. Истинную молекулярную массу соединения найдем по его относительной плотности по водороду:
М = DH2×M(H2) = 16×2 = 32
Отношение истинной молекулярной массы к условной:
n = M/M’ = 32/16 = 2
определяет величину множительного коэффициента при переходе от простейшей к молекулярной формуле соединения:
(NH2)n = (NH2)2 = N2H4
Следовательно, молекулярная формула данного водородного соединения азота N2H4 и соединение является гидразином.
Пример 14. При сжигании 4,6 г органического соединения было получено 8,8 г CO2 и 5,4 г H2O. Определить молекулярную формулу соединения, если плотность его паров по воздуху 1,586.
Решение. Так как 1 моль углекислого газа (44 г) содержит один моль атомов углерода (12 г), то в 8,8 г CO2 содержится:
m(C) = (12/44)×8,8 = 2,4 г
Аналогично определяем массу водорода в 5,4 г воды:
m(H) = (2/18)×5,4 = 0,6 г
Суммарная масса углерода и водорода в сгоревшем органическом соединении с массой 4,6 г составляет только 3 г, что указывает на присутствие в нем также атомов кислорода:
m(O) = 4,6 – 3 = 1,6 г
Таким образом, массовое соотношение атомов C, H и O, входящих в состав соединения c простейшей формулой СхНуОz, составляет:
m(С): m(H): m(O) = 2,4: 0,6: 1,6
и с учетом относительных атомных масс:
х: у: z = 2: 6: 1
Следовательно, простейшая формула соединения - С2Н6О с условной молекулярной массой M’ = 46.
Истинную молекулярную массу соединения найдем по его относительной плотности по воздуху:
М = DB×MB = 1,586×29 = 46
Равенство истинной и условной молекулярных масс показывает, что молекулярная формула соединения совпадает с его простейшей формулой С2Н6О.
 Упражнения:
Упражнения:
95. Определить процентное (по массе) содержание каждого элемента в соединениях: а) азотной кислоте, б) гидроксиде железа (III), в) сульфате меди (II).
96. Найти простейшую формулу вещества, содержащего 63,49 % серебра, 8,25 % азота и 28,26 % кислорода.
97. Найти молекулярную формулу соединения, содержащего 92,3 % углерода и 7,7% водорода, если известно, что при н.у. масса 3 л паров этого вещества равна 10,53 г.
98. Соединения бора с водородом содержит 78,18 % бора. Плотность по гелию 6,855. Определить молекулярную формулу вещества.
99. Установить молекулярную формулу вещества, состоящего из углерода, водорода и кислорода, если отношения их масс - 6: 1: 8 и плотность пара данного вещества по воздуху равна 2,07.
100. Соединение серы с фтором содержит 62,8 % S. Масса 0,177 л паров данного вещества, измеренного при 7º С и давлении 740 мм рт.ст, равна 0,765 г. Какова молекулярная формула соединения?
101. Определить молекулярную формулу соединение бора с водородом при содержании в нем 78,18% бора и плотности паров по водороду 13,71.
102.Фтороводород содержит 50% фтора и при некоторой температуре плотность его пара по водороду равна 20. Какова молекулярная формула фтороводорода при этой температуре? Как изменится молекулярная формула фтороводорода, если при повышении температуры плотность его пара становится равной 10?
103. При сжигании 0,24 г некоторого соединения NxHy получено 0,27 г воды и 168 мл азота (при 0 ºС и 101,3 кПа). Плотность пара водородного соединения азота по воздуху 1,1. Определить молекулярную формулу соединения.

Индивидуальное домашнее задание № 1
по теме «Химический элемент, химическое соединение».
Вариант 1.
1. Приведите химические элементы, в латинском названии которых содержится греческое слово “ genes ” – «образующий, рождающий».
2. Дайте определение оксидам. Систематические названия оксидов. Классификация оксидов (приведите по 3 примера оксидов каждого типа). Приведите графические формулы следующих бинарных кислородных соединений: Mn2O7, Mn3O4, MnO2, OF2, BaO2 и обоснуйте, какие из них относятся к оксидам. Приведите примеры реакций получения оксидов.
3. Приведите реакции, демонстрирующие амфотерность гидроксида цинка и получение на его основе аква-, гидроксо- и оксокомплексов.
4. Напишите уравнения реакций и название химических соединений: CaO® Ca(OH)2®CaCO3®Ca(HCO3)2®CaCO3®(CaOH)2CO3®CaCO3®CaO.
5. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте название следующим комплексным соединениям: [Co(NH3)3(NO3)3], Li[CrEnF4], [Pd(NH3)3(H2O)](ClO4)2, (NH4)2[PtCl6], [Fe(CO)5], K3[Ru(OH)3(CN)3], Cs[Cu(CO)(SCN)3], [Pd(N2H4)2] Br2, HSeO3Cl.
6. Три различных углеводорода имеют одинаковый элементный состав: 85,7% углерода и 14,3% водорода. При нормальных условиях масса одного литра каждого из веществ составляет: 1,87 г, 2,5 г и 3,75 г. Определить молекулярные формулы углеводородов.
Вариант 2.
1. Что общего в названии элементов: эрбий, тербий, иттрий, иттербий? Классифицируйте эти элементы по положению в периодической системе – группа, период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп; название семейства.
2. Приведите классификацию гидроксидов и обоснуйте характер изменения кислотно-основных свойств гидроксидов непереходных элементов в зависимости от их положения в периодической системе. Как образуются систематические названия основных гидроксидов? Укажите название и приведите графические формулы следующих гидроксидов Fe(OH)3, TlOH, Ca(OH)2, NH3×H2O, N2H4×H2O, NH2OH×H2O. Приведите реакции, демонстрирующие общие методы получения основных гидроксидов.
3. Напишите уравнения реакций и название химических соединений: Cr® CrCl2®Cr(OH)Cl®Cr(OH)2®Cr(OH)3®NaCrO2®Na3[Cr(OH)6]® Na2Cr2O7.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность и амбидентатность лигандов и дайте систематическое название следующим соединениям: [CoEn2Cl2]NO3, Na2[HgI4], Al(H2O)3(OH)3, Ni(CO)4, K4[Fe(CN)6], [Co(SCN)2(NH2OH)2], [Cu(NH3)2][CrEdta], [Pt(NH3)5Br](NO3)3, [Ru(CN)2(OH)2]SO3.
5. Приведите молекулярные формулы соединений: сульфат цианопентаамминродия(III), диоксодигидрофосфат(I) калия, гексахлороиридат(IV) аммония, гексароданохромат(III) пентаамминкобальта(III).
6. Установить формулу кристаллогидрата сульфата натрия, если при его обезвоживании потеря массы составляет 47% от массы кристаллогидрата.
Вариант 3.
1. Название каких элементов связано с цветовой гаммой? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Систематические и традиционные названия простых веществ. Что такое аллотропия, аллотропные модификации состава и формы – приведите примеры. Существуют ли аллотропные модификации формы для простых веществ в газовой фазе? Приведите примеры, демонстрирующие различные методы для указания в формуле простого вещества его аллотропной формы. Химические элементы условно классифицируют на металлы и неметаллы. Сохраняется ли такая классификация для их простых веществ: в твердом состоянии, в газовой фазе? Приведите реакции, демонстрирующие общие методы получения простых веществ.
3. Напишите уравнения реакций и название химических соединений: Ba® BaO®Ba(OH)2®(BaOH)2CrO4®BaCrO4®BaCr2O7
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: [RhEn2Cl2]2SO4, Na2[HgCl4], Ni(CO)4, Na2ZnO2, [Co(H2O)2(OH)2(CN)2]ClO3, [Cr(N2H4)4CO3]2CO3, [NiEn2][NiCl4], Na2S2O6(O2).
5. Приведите молекулярные формулы соединений: перхлорат цианопентаамминплатины(IV), бис(триоксо)сульфат(VI) натрия, бисдиметилглиоксиматоникель, триоксованадат(V) натрия.
6. Определить число молекул в 1 г соединения, содержащего 53,3% углерода, 15,7% водорода и 31,1% азота, если плотность его пара по воздуху 1,55.
Вариант 4.
1. Приведите названия элементов, связанных: с Францией, Германией, Россией, Польшей, Шотландией. Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Опишите два метода образования систематических названий бинарных соединений (приведите примеры). Приведите примеры специальных названий многоатомных анионов и бинарных соединений на их основе. Как называются водородные соединения галогенов, халькогенов, р-элементов V и IV группы, а также бора? Приведите примеры. Приведите все возможные названия следующих соединений: Hg2Cl2, Na3P, TeF6, BaH2, RbO3, CsO2, CaO2, NaN3, OsO4, CaC2, SbH3, P2H4, HBr, B2H6.
3. Напишите уравнения реакций и названия химических соединений: Fe2O3® FeCl3®Fe(OH)Cl2®Fe(OH)2Cl®Fe(OH)3®FePO4®Fe2(HPO4)3®Fe(H2PO4)3.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: [Cr(H2O)3С2O4Cl], Na2[RuO4], [PdDMG], H[AuBr4], Ba[Co(SCN)4(NH2OH)2]2, Na3[AlF6], [Pt(NH3)4][PtCl4], [CuEn2]3(PO4)2, [Cr(H2O)(NH3)5](NO3)6.
5. Приведите молекулярные формулы соединений: гидросульфат ди(тиоцианато)диамминдиаквахрома(III), тетрахлорониколлат(II) натрия, пентакарбонилжелезо, нитрат динитритобисэтилендиаминрутения(III), тетрацианоплатинат(II) диамминмеди(II), гексаоксоиодат(VII) водорода.
6. Определить число молекул в 1 г соединения, содержащего 40,3% бора, 7,51% водорода и 52,2% азота, если 2,3 л этого соединения в виде газа при 60 0С и 101,3 кПа имееют массу 6,78 г.
Вариант 5.
1. Приведите названия элементов, названных в честь столичных городов. Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Приведите функциональную классификацию сложных неорганических веществ. Классифицируйте следующие соединения: СO, Na2O, ZnO, Mn2O7, Pb3O4, Ba(OH)2, Al(OH)3, AlO(OH), HClO4, H5IO6, H4P2O7, HSO3Cl, HCN, SeO2F2, NaNO3, CaCl(ClO), (KFe)(SO4)2, Al(OH)2Cl, Fe2(HPO4)3, укажите их названия и приведите графические формулы.
3. Напишите уравнения реакций и названия химических соединений алюминия: Al®Na3[Al(OH)6]®Al(OH)3®Na[AlO2]®AlCl3®Al(OH)Cl2®Al(OH)2Cl ®Al(OH)3®Al2O3.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: K3[Fe(C2O4)3], K3[Al(OH)6], [CoEn2(NH3)2](NO3)2, Na2[Fe(CO)(CN)5], Na[Co(ЭДТА)Сl2], Rb[B(OH)4], [Co(NH3)4CO3]2(CO3).
5. Приведите молекулярные формулы соединений: гексахлороиридат(IV) натрия, дитиосульфатоаргентат(I) лития, тетраиододиамминродий, трихлоротриамминплатинат(IV) хлоротриамминплатины(II).
6. Определить число молекул в 1 г соединения серы со фтором, содержащего 62,8% серы, если 118 мл этого соединения в виде газа при 7 0С и 98,64 кПа имеют массу 0,51 г.
Вариант 6.
1. Что общего в названии элементов: неодим, празеодим? К семейству и подсемейству каких элементов они относятся?
2. Сформулируйте правила образования традиционных названий оксокислот р-элементов III-VI и VII группы, приведите примеры. Приведите традиционные и систематические названия, а также графические формулы следующих кислот: H2S2O7, HPO3, H2PHO3, HPH2O2, H2SeO3, H5IO6, HIO4, HClO3, HClO2, HBrO, H2N2O2, H4TiO4, HVO3, H2Cr2O7, H2MnO4, HF, HCN, HCNS, H2Se. Приведите реакции перехода: H4SiO4®H2SiO3®H2Si2O5®H2Si3O7.
3. Написать уравнения реакций между кислотами и основаниями, приводящих к образованию следующих солей: нитрата натрия, гидросульфата натрия, дигидродифосфата натрия, сульфида гидроксобария, карбоната гидроксомеди.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: K[Au(CN)2], Na[Fe(H2O)2Edta], Ni(CO)4, [Ru(N2)(NH3)4(NH2OH)2](ClO4)2, [CuEn2][PF6]2, Na[AlO2], [Pd(H2O)(NH3)2Cl]I, (NH4)2[HgI4], [PtDMG].
5. Приведите молекулярные формулы соединений: пентагидрат тетраоксосульфат(VI) меди(II), перхлорат цианопентаамминродия(III), трисоксалатоферрат(III) натрия, тригидродифосфат карбонатотетраамминкобальта(III.
6. Определить молекулярную формулу кристаллогидрата хлорида бария, если 36,6 г соли при прокаливании теряют в массе 5,4 г.
Вариант 7.
1. Названия каких элементов в переводе с греческого означают: «первый» и “не единственный”? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Сформулируйте правила образования традиционных названий замещенных оксокислот, приведите примеры. Приведите традиционные и систематические названия, а также графические формулы следующих кислот: H2S2O6(O2), H2SO3(O2), HNO2(O2), H3AsO3S, H3AsO2S2, H3AsOS3, H3AsS4, HAsS3, H2S4O6, H2S2O6, H2PO3Cl, H2AsO3(NH2), H4P2O6(NH), HSO3Br, H2S2O4(NH).
3. Напишите уравнения реакций и названия химических соединений: C®CO® CO2®BaCO3®Ba(HCO3)2®(BaOH)2CO3®BaCO3.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематические названия следующим соединениям: K3[Fe(CN)6], Na[Ag(CN)2], Mg[Co(H2O)2(C2O4)2], [RuEn2(CN)2]2(SO4)2, [Os(NH3)5(N2)](NO3)2.
5. Приведите молекулярные формулы соединений: сульфатопентаакваплатинат(IV) бис(этилендиамин)платины(II), диметилглиоксиматоникель, циановодородная кислота, иодобромодихлоромеркурат (II) цезия.
6. Определить число молекул в 1 г органической кислоты, содержащей 51,5% углерода и 6,25% водорода, если плотность ее паров по воздуху 4,41.
Вариант 8.
1. Названия каких элементов связаны с именами выдающихся ученых? Кратко охарактеризуйте научные достижения этих ученых.
2. Сформулируйте правила образования систематических и традиционных названий галогенагидридов, приведите примеры. Приведите традиционные и систематические названия, а также графические формуды следующих соединений: POBr3, SOCl2, SbCl5, AsOBr, SO2ClF, CO2I2, SiBr4, SiOCl2, NOF, SeO2BrCl; напишите реакции их взаимодействия с водой.
3. Напишите уравнения реакций и названия химических соединений кремния: Si®SiO2®Na2SiO3®Na2Si2O7®H2SiO3®(CuOH)2SiO3.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематические названия следующим соединениям: СsAlO2, Na2[Pt(CN)4ClBr], [RhEn2(NO2)2]2SO4, [Pt{P(C6H5)3}2Cl2], [Cu(H2O)2C2O4], [XeF5][CoIIIF4], H[AuIIICl4], K3[Fe(SCN)5(N2H4)].
5. Приведите молекулярные формулы соединений: тетраоксованадат(V) аммония, гексатиоцианатоферрат(III) натрия, тетрахлороплатинат(II) бис(этилендиамин)меди(II), трицианоникколат(I) калия, гексагидроксохромат(Ш) лития.
6. При сгорании 4,3 г углеводорода образовалось 13,2 г углекислого газа. Плотность пара углеводорода по водороду 43. Определить молекулярную формулу углеводорода и массу его одной молекулы.
Вариант 9.
1. Названия каких элементов имеют географическое происхождение? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Опишите классификацию солей по составу и приведите примеры солей разных типов. Сформулируйте правила образования традиционных названий средних солей. Приведите традиционные и систематические названия, а также графические формулы следующих солей: Fe2(SeO3)2, Hg2(NO3)2, K4P2O7, Na3AsO3, NaH2РO2, Ba(ClO)Cl, KFe(SO4)2, NaClO4, KBrO3, Ba5(IO6)2, K2FeO4, Fe3O4, NH4VO3, KMnO4, Ni(NO3)2, Na2S2O3.
3. Напишите уравнения реакций и название химических соединений: P4® P4O10®H4P2O7®H3PO4®Ca(H2PO4)2®CaHPO4®Ca3(PO4)2®(CaOH)3PO4
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематические названия следующим соединениям: Na[Zn(H2O)(OH)3], Li2[PtEn2Br2I2], (NH4)2[RuVF6], [Pt(H2O)(NH3)2(OH)](HSO4), [Cr(H2O)3(C2O4)Cl], [Cr(SO3)2](NO3)2, Li3[Fe(SCN)5(NH2OH)].
5. Приведите молекулярные формулы соединений: тетрациономеркурат(II) калия, гексагидроксоалюминат натрия, тетрахлоропалладат(II) бис(этилендиамин)палладия(II), селеновая кислота, озонид цезия.
6. При полном сгорании навески 1,88 г органического бромосодержащего вещества получено 0,88 г углекислого газа и 0,3 г воды. После превращения всего брома, содержащегося в навеске, в бромид серебра получено 3,76 г AgBr. Плотность паров вещества по водороду составляет 94. Определить молекулярную формулу соединения.
Вариант 10.
1. Что общего в названиях элементов: ниобий, тантал, титан, прометий, тантал, ванадий, торий? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Какие соли называются кислыми? Обоснуйте, какие из следующих солей являются кислыми: K2HPO4, K2PHO3, K2H2P2O7, KPH2O2? Сформулируйте правила образования традиционных названий кислых солей и приведите примеры. Приведите традиционные и систематические названия, а также графические формулы следующих солей: Fe(HSe)2, BaH2P4O7, Ni(HSO3)2, Ca3(H2IO6)2, Co(HAsO3), Mg(HSbO4), KHPO2Cl, Na2HPO3S. Напишите реакции перехода: BaHPO4 ® Ba(H2PO4)2 ® Ba3(PO4)2 ® (BaOH)3PO4.
3. Написать уравнения реакций, с помощью которых в лаборатории можно получить следующие вещества: хлороводород, сульфид свинца(II), сульфат бария, ортофосфат серебра, гидроксид железа(III), нитрат меди(II).
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов; дайте систематические названия соединениям: Na2[CS3], Li[Zn(CO)(SCN)3], Na3[Ir(C2O4)2Cl2], [PtEn2]2[Fe(CN)6], [Cr(H2O)4Cl2]I, [RhBr3(NH3)3].
5. Приведите молекулярные формулы соединений: дигидрофосфат аммония, нитрат динитритотетраамминкобальта(III), гексахлороиридат(IV) магния, гексафтороплатинат(V) водорода, дифторид кислорода, тиоцианато-водородная кислота, гидрат аммиака.
6. Определить молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2%. Во сколько раз различаются массы одной молекулы этого бороводорода и молекулы азота?
Вариант 11.
1. Классифицируйте данные элементы (Mg, Pt, Ni, K, P, Se) по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Какие соли называются основными? Обоснуйте, какие из следующих солей являются основными: [Al(OH)2]2SO4, (AlOH)SO4, Al2(SO4)3, Al(HSO4)3? Сформулируйте правила образования традиционных названий основных солей и приведите примеры. Приведите традиционные и систематические названия, а также графические формулы следующих солей: [Fe(OH)]2Se, Al(OH)2I, [Cu(OH)]2CO3, (ZnOH)NO2, (NiOH)3AsO4, (BaOH)2SO4, Fe(OH)Br2, BiOCl, UO2(NO3)2, (SbO)2SO4. Напишите реакции перехода: [Al(OH)2]3PO4®[Al(OH)]3(PO4)2®Al3PO4®Al2(HPO4)3® Al(H2PO4)3.
3. При взаимодействии каких веществ можно получить: дигидроортоантимонат натрия, метахромит натрия, гидроортоарсенат калия, сульфат гидроксоалюминия. Привести уравнения реакций и графические формулы солей.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: Na[BH4], H[MoCl4], Na[RhEn(C2O4)Cl2], [Co(H2O)(OH)Edta], [Cu(NH3)4][Pt(NO2)4], H[AuBr4], Fe[Ir(NCS)6].
5. Приведите молекулярные формулы соединений: хлорид дихлоротетрааквахрома(III), азидоводородная кислота, тетрацианопалладат(II) калия, гексафторорутенат(V) аммония, хлорангидрид азотной кислоты, декагидрат сульфата натрия.
6. Вычислить процентное (по массе) содержание каждого из элементов в соединениях: гидроксид магния, нитрат железа (III), серная кислота, перманганат калия. Сколько молекул содержится в 100 г углекислого газа при н.у.?
Вариант 12.
1. Приведите названия элементов, связанных с органо-лептическими свойствами их соединений. Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Приведите примеры комплексных соединений различных типов: катионных, нейтральных, анионных, катионно-анионных; аммиачных, аминных, гидроксокомплексов, аквакомплексов, ациодокомплексов, карбонилы; однородных и смешанно-лигандных комплексов; моноядерных и полиядерных; хелатных и внутрикомплексных; кластерных комплексов. Классифицируйте следующие комплексные соединения: [Pt(NH3)4]Cl2, Na3[Al(OH)6], [CrEn2ClCO3], Fe(CO)5, [NiDMG], Na2[Re2Cl8], [Cr(NH3)6][Cr(CN)6] и приведите их систематические названия.
3. Напишите уравнения реакций и название химических соединений: Zn® Na2[Zn(OH)4]®Zn(OH)2®Na2[ZnO2]®ZnSO4®Zn(HSO4)2®(ZnOH)2SO4.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: KMnO4, K3[Cr(OH)6], [NiEdta], H[AuCl4], Ca[Cu(SO3)2(N2H4)2].
5. Приведите молекулярные и графические формулы, напишите названия веществ: HNO2, K3AsO4, NaHSO4, AlOHBr2, Fe(OH)2ClO4.
6. Сколько атомов азота содержится в 1 кг следующих соединений: нитрата калия, диоксонитрата(III) аммония, гидрофосфата аммония.
Вариант 13.
1. Приведите химические элементы, названия которых связаны с другими химическими элементами. Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Какие соединения называются аддуктами и как записывается их химическая формула? Что такое клатраты (приведите примеры)? Сформулируйте правила образования названий аддуктов. Приведите названия следующих соединений: СuSO4×5H2O, 6Ar×46H2O, Na2B4O7×10H2O, (UO2)3(AsO4)2×12H2O, Mn(H2PO4)2×2H2O, Cl2×6H2O, 2K2CO3×3H2O2, CaCl2×6NH3, 10PF3×29Br2.
3. Напишите уравнения реакций и названия химических соединений: Cu® Cu(NO3)2®Cu(OH)2®(CuOH)2CO3®CuCO3®Cu(HCO3)2®Cu®Na3CuO2.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематические названия следующим соединениям: Ni(CO)4, K2[Pt(C2O4)2], [Ru(NH3)5CO3]ClO4, [Cr(H2O)3(CO3)Cl], [СoClBr(NH3)2]NO3, H2[SiF6].
5. Приведите молекулярные формулы соединений: фосфин, нитрид кобальта(II), периодат калия, тетрабромомеркурат(II), трицианотриамминкобальт, гидрофосфат натрия, тиосульфат калия, гидрат гидразина.
6. Какую массу железа можно получить из 2 т железной руды, содержащей 94% (масс.) Fe2O3? Сколько атомов содержится в этой массе железа?
Вариант 14.
1. Названия каких химических элементов связаны с астрономическими объектами солнечной системы? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Определите понятия: внутренняя сфера комплекса, внешняя сфера комплекса, координационный центр, координационное число, лиганд, дентатность лиганда, мостиковый лиганд, хелатирующий лиганд (приведите примеры). Какие типы изомерии наиболее характерны для комплексных соединений – приведите примеры различных изомеров. Классифицируйте следующие лиганды: NH3, N2H4, NH2CH2CH2NH2, NO2-, CN-, CNS-, Cl-, OH-, CO - по их дентатности, хелатирующей способности. Приведите названия этих лигандов в составе внутренней сферы комплексов.
3. Напишите уравнения реакций и названия химических соединений: C®CO® CO2®NaHCO3®Na2CO3®(CuOH)2CO3®[Cu(NH3)4](OH)2.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематические названия следующим соединениям: Fe(CO)5, [Pd{P(C6H5)3}Cl2], [Ru(H2O)(NH3)3CO3], [FeEdta]NO3, Pb2[PbO4], Fe[Pt(NH3)3(CN)3], H[AuCl6].
5. Приведите молекулярные формулы соединений: дифосфорная кислота, хлорит-гипохлорит кальция, метаванадат аммония, нитрат хлоротриамминплатины(II), сульфат дигидроксоалюминия, гексагидрат хлороводорода.
6. При взаимодействии 5 мл газообразного углеводорода с 25 мл кислорода образовалось 15 мл газообразного диоксда углерода и 20 мл паров воды. Определить молекулярную формулу углеводорода.
Вариант 15.
1. Названия каких химических элементов указывает на трудности их выделения? Классифицируйте эти элементы по положению в периодической системе - группа (групповое название), период; s-, p-, d-, f-; переходные, непереходные; типические элементы и элементы подгрупп.
2. Сформулируйте правила образования систематических названий комплексных соединений следующих типов: катионных, анионных, нейтральных; (приведите примеры).
3. Напишите уравнения реакций и названия химических соединений: NO2® Ba(NO3)2®HNO3®Al(OH)2NO3® AlOH(NO3)2®Al(NO3)3.
4. Определите заряд центрального иона комплексообразователя, его координационное число, дентатность лигандов и дайте систематическое название следующим соединениям: K2MnO4, [Cr(H2O)3(NCS)3], Mg[Co(C2O4)2(N2)2], Ba[Ag(CN)2]2, [Cu(NH3)4(H2O)2]SO4, K4[Fe(CN)6].
5. Приведите молекулярные формулы соединений: октасера, декаоксид тетрафосфора, хлорноватистая кислота, метамышьяковистая кислота, манганат бария, гексахлороплатинат(IV) водорода, тетракарбонилкобальт, гидрат аммиака.
6. Парциальное давление кислорода в воздухе составляет 160 мм.рт.ст. Определить содержание кислорода в воздухе в объемных процентах. Сколько молекул кислорода содержится при нормальных условиях в 1 л воздуха?
Приложение 1. Названия химических элементов
| Символ Ср. ат. масса | НАЗВАНИЕ | ||||
| Латинское | Русское | Английское | |||
| H 1,0079 | Hydrogenium | Водород (рождающий воду), 1766 Г. Кавендиш (Англия) | Hydrogen (греч. ‘hydro genes’ – образующий воду) | ||
| He 4,0026 | Helium | Гелий (греч. ‘гелиос’ – солнце), 1895. У. Рамзай (Англия), П. Клеве и Н.А. Лагле (Швеция) | Helium | ||
| Li 6,941 | Lithium | Литий (греч. 'литос’ – камень), 1817 А. Арфедсон (Швеция), анализ минерала LiAl[Si4O10] | Lithium | ||
| Be 9,0122 | Beryllium | Берилий (греч. ‘бериллос’ – берилл – название полудрагоценного камня), 1798 Л. Воклен (Франция) | Beryllium | ||
| B 10,81 | Borum | Бор (араб. – «бурак» – бура), 1828 Ж. Гей-Люссак и Л. Тенар (Франция) из борной кислоты | Boron | ||
| C | Carboneum | Углерод (рождающий уголь) | Carbon (лат. ‘carbo’ – уголь) | ||
| N 14,007 | Nitrogenium | Азот (греч. ‘ аз зоэ’ – безжизненный), 1772 Д. Розерфорд (Англия), название А. Лавуазье (Франция) | Nitrogen (греч. ‘nitron genes’ образующий селитру | ||
| O 15,999 | Oxygenium | Кислород (рождающий кислоты), 1774 Дж. Пристли (Англия), К. Шееле (Швеция) | Oxygen (греч. ‘oxy genes’ – образующий кислоты) | ||
| F 18,998 | Fluorum | Фтор (греч. ‘фторос’ – разрушение, гибель), 1886 А. Муасан (Франция) | Fluorine (лат ‘fluere’ – течь) | ||
| Ne 20,179 | Neon | Неон (греч. ‘неос’ – новый), 1898 У. Рамзай и М.У. Траверс (Англия) | Neon | ||
| Na 22,990 | Natrium | Натрий (араб. “ натрон” - щелочь), 1807 Г. Дэви (Англия) | Sodium (от англ. ‘soda’) | ||
| Mg 24,305 | Magnesium | Магний (греч. ‘магнезия’ – название полуострова в Греции), 1808 Г. Деви (Англия) | Magnesium | ||
| Al 26,982 | Aluminium | Алюминий (лат. ‘alumen’ – квасцы), 1825 Х. Х. Эрстед (Дания) | Aluminium | ||
| P 30,974 | Phosphorus | Фосфор (греч. ‘фосфорос’ – несущий свет), 1669 Х. Бранд (Германия) | Phosphorus | ||
| S 32,06 | Sulfur | Сера (санскрит ‘сира’ – светло-желтый), известна с доисторических времен | Sulfure | ||
| Cl 35,453 | Chlorum | Хлор (греч. ‘хлорос’ – зеленоватый), 1774 К. Шееле (Швеция) | Chlorine | ||
| Ar 39,948 | Argon | Аргон (греч. ‘аргос’ – неактивный), 1894 Дж. Релей и У. Рамзай (Англия) | Argon | ||
| K 39,098 | Kalium | Калий (араб. ‘аль кали’ – зола), 1807 Г. Дэви (Англия) | Potassium (англ. ‘potash’) | ||
| Ca 40,08 | Calcium | Кальций (лат. ‘kalx’ – мягкие, легко обрабатываемые минералы – известняк, мел …), выделен в 1808 Г.Деви (Англия) | Calcium | ||
| Sc 44,956 | Scandium | Скандий (от лат. ‘скандиа’ – Скандинавия), 1879 Л.Ф. Нильсон (Швеция) | Scandium | ||
| Ti 47,90 | Titanium | Титан (греч. в честь ‘титанов’ – сыновей Урана и Геи), 1791 У. Грегор (Англия) и 1795 М. Клапрот (Германия) | Titanium | ||
| V 50,941 | Vanadium | Ванадий (сканд. ‘Ванадис’ - богиня красоты), 1830 Н. Сефстрем (Швеция) | Vanadium | ||
| Cr 51,996 | Cromium | Хром (греч. ‘хрома’ – цвет), 1780 Н.-Л. Воклен (Франция) | Cromium | ||
| Mn 54,938 | Manganum | Марганец (лат. ‘magnes’ – магнит), 1774 Ю. Ган (Швеция) | Manganese | ||
| Fe 55,847 | Ferrum | Железо - относится к семи «доисторическим металлам» - Ag, Au, Cu, Sn, Fe, Pb, Hg (славянский корень “лезо” – лезвие) | Iron | ||
| Co 58,9332 | Cobaltum | Кобальт (нем. ‘кобальд’ – гном), 1735 Г. Бранд (Швеция) | Cobalt | ||
| Ni 58,70 | Niccolum | Никель (нем. ‘rupfernickel’ – дьявольская медь, или медь Св. Николаса), 1751 А. Кростедт (Швеция) | Nickel | ||
| Cu 63,546 | Cuprum | Медь – относится к семи «доисторическим металлам» - Ag, Au, Cu, Sn, Fe, Pb, Hg (греч. “металлон” – рудник, копь) | Copper (лат. ‘Cuprum’ – Кипр) | ||
| Zn 65,38 | Zinkum | Цинк (нем. ‘zink’) – известен в древности (в Индии его получали еще в V в. до н.э.) | Zinc | ||
| Ga 69,72 | Gallium | Галлий (франц. ‘Gallia’ – Франция), 1875 П.-Э. Леккок (Франция) | Gallium | ||
| Ge 72,59 | Germanium | Германий (лат. ‘Germania’ – Германия), 1886 К.А. Винклер (Германия) | Germanium | ||
| As 74,922 | Arsenicum Antimonium | Мышьяк - известен с глубокой древности, получение свободного мышька приписывают А. фон-Больштедту в 1250 г. | Arsenic (греч. ‘arsenikon’ – желтый пигмент) | ||
| Se 78,96 | Selenium | Селен (греч. ‘селена’ – луна), 1817 Й. Берцелиус (Швеция) | Selenium | ||
| Br 79,904 | Bromium | Бром (греч. ‘бромос’ – зловонный), 1826 А.Ж. Балар (Франция) и С. Левиг (Германия) | Bromine | ||
| Kr 83,80 | Krypton | Криптон (греч. ‘криптос’ – скрытый), 1898 У. Рамзай и М.У. Траверс (Англия) | Krypton | ||
| Rb 85,468 | Rubidium | Рубидий (лат. ‘ rubidius’ – темно-красный), 1861 Р.В. Бунзен и Г. Кирхгоф (Германия) | Rubidium | ||
| Sr 87,62 | Strontium | Стронций (англ. ‘Strontian’ – название шотландского селения), 1790 А. Кронфорд (Шотландия) | Strontium | ||
| Y 88,906 | Yttrium | Иттрий (назван по минералу иттербиту, найденному у селения Иттербю, Швеция), 1794 Ю. Гадолин (Финляндия) | Ytterbium | ||
| Zr 91,22 | Zirconium
Дата добавления: 2014-10-15; Просмотров: 2603; Нарушение авторских прав?; Мы поможем в написании вашей работы! |
Генерация страницы за: 0.012 сек.