
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И химическая идентификация углеводородов и производных 8 страница
|
|
|
|
"Cтроение молекул и изомерия органических соединений"
Рекомендуемая литература: [1, гл. 13, § 13.1]; [3, гл. 29, § 29.3]; [4, гл. 13, § 2]; лекции.
Комплексное тестовое задание 27. Структурная изомерия
А. Для данного в Вашем варианте соединения (таблица 29, с. 56-60) выберите из набора анализируемых соединений (1, 2, 3 или 4) его структурный изомер указанного в таблице определяемого типа.
Б. Назовите ряд, класс и систематическое название данного соединения и найденного изомера. Приведите их структурные и молекулярные (брутто) формулы и обоснуйте, почему эти вещества являются структурными изомерами данного типа, каково различие в их химическом строении. Укажите, в чем проявляется различие в свойствах этих соединений.
Тестовое задание 28. Пространственная изомерия
А. Из числа анализируемых соединений (1, 2, 3 или 4, таблица 30) выберите соединение, имеющее указанный в Вашем варианте определяемый вид пространственной изомерии.
Б.Изобразите структурные формулы двух пространственных изомеров определяемого вида для выбранного Вами соединения. Укажите, почему этот вид пространственной изомерии возможен для выбранного соединения, и чем отличаются по строению и свойствам эти пространственные изомеры.
Таблица 30 – Варианты тестовых заданий
| Ва ри- ант | Вид определяемой пространственной изомерии | Набор анализируемых соединений и ответов | |||
| Оптическая | СН3СН(ОН)СОOH | СН3СН2COOН | СН3ОСН2СН2ОН | СН3СОСНО | |
| Геометрическая | С7Н16 | 
| 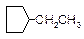
| С6Н5СН3 | |
| Геометрическая | СН3СН2СН2СН3 | СН3СН2С≡СН | СН3СН2СН=СН2 | СН3СН=СНСН3 | |
| Оптическая | СН3СН2СНОНСН3 | СН3СН2ОСН2СН3 | С3Н7СОСН3 | СН3СН2СН2СHО | |
| Геометрическая | СН2=СНСООСН3 | СН3СН2СН2СООН | СН3СН=СНСООН | СН2=CHСН2СОOH | |
| Оптическая | СН3(СН2)2СНО | СН3СН2СН(СН3)ОН | СН3СН2СН2ОН | СН3СОСН2СН3 | |
| Оптическая | СН2ОНСН(СН3)2 | СН2ОНСН2СООН | СН2ОНСН2СООСН3 | СН3СН2СНОНСООН |
Продолжение таблицы 28.1
| Ва ри- ант | Вид определяемой пространственной изомерии | Набор анализируемых соединений и ответов | |||
| Геометрическая | СН3СН=СНСOOCН3 | СН3ОСН=С(СН3)2 | СН2=СНСН2СООН | СН2=СНСOOCН3 | |
| Геометрическая | 
| 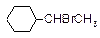
| 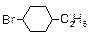
| 
| |
| Оптическая | 
| 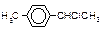
| 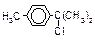
| 
| |
| Оптическая | СН3СНОНСН2ОН | СН2ОН(СН2)2СНО | СН3СН2СООСН3 | СН3СОСН2ОН | |
| Геометрическая | СН3СН=СНСН2NН2 | СН2=СНСН(СН3)NН2 | СН2=С(С2Н5)NН2 | СН2=СНСН2NHСН3 | |
| Оптическая | СН3(СН2)2СОСН3 | СН3СН2СН(СН3)СНО | СН3(СН2)2СНО | СН3(СН2)2СН2ОСН3 | |
| Оптическая | 
| 
| 
| 
| |
| Оптическая | СН2ОН(СН2)3Сl | (СН3)2С(ОН)СН2Сl | СН2ОНСН2СН2Сl | СН2ОНСН(СН3)СН2Сl | |
| Геометрическая | СН2=СНСН2СН2СН3 | СН3СН=СНСНСН3 | 
| (СН3)2СНСН=СН2 | |
| Оптическая | CH3CH2CH(CH3)CONH2 | (CH3)2CHCH2CONH2 | CH2(NH2)(CH2)2CHO | CH3CH2CH2CONH2 | |
| Оптическая | СН3CH(NH2)CH2CH2OН | СН3CH2CH2CONH2 | CH2(NH2)(CH2)2OCH3 | (CH3)2CH(NH2)CH2OH | |
| Геометрическая | 
| 
| 
| 
| |
| Геометрическая | (СН3)2С=СНСН2ОН | СН3СН=СНСН2ОСН3 | СН2=СН(СН2)3ОН | СН2=СН(СН2)2СНО | |
| Геометрическая | 
| 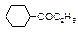
| 
| 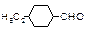
| |
| Оптическая | CH3CH2CH(Cl)CH2OH | CH2Cl(CH2)2CHO | CH2(OH)CH2CH2Cl | (CH3)2CHCOCl | |
| Геометрическая | (CH3)2C=CHNO2 | CH2=CH(CH2)2NO2 | (NO2)CH=CHCH2CH3 | CH2=CHCH2CH2ONO | |
| Оптическая | CH3CH2CONH2 | (CH3)2C(NH2)COOH | CH2(NH2)CH2COOH | CH3CH(OH)CONH2 | |
| Геометрическая | 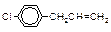
| 
| 
| 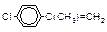
| |
| Оптическая | CH3CH2CH(CH3)OCH3 | CH3(CH2)2CHO | CH3(CH2)3OH | CH3CH2COCH3 | |
| Геометрическая | 
| 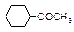
| 
| 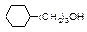
|
Продолжение таблицы 30
| Ва ри- ант | Вид определяемой пространственной изомерии | Набор анализируемых соединений и ответов | |||
| Оптическая | (СН3)2CHCH2CH2SO2OH | 
| СН3(CH2)2CH2SO2OCH3 | СН3(CH2)2-CH2SO2OH | |
| Геометрическая | 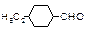
| 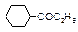
| 
| 
| |
| Геометрическая | CH2=CH(CH2)2CH2Cl | (CH3)2C=CHCH2Cl | CH3CH2C(Cl)=CHCH3 | CH2=C(Cl)(CH2)2CH3 |
2.15 Комплексное тестовое задание 29 по теме "Химические свойства
углеводородов"
Рекомендуемая литература: [1, гл. 13, §§ 13.2, 13.3]; [3, гл. 29, §§ 29.5-29.17]; [4, гл. 13, § 3]; лекции.
А. Укажите, с соединением какого класса органических веществ (1, 2, 3 или 4, таблица 31) вступит в реакцию реагент, данный в таблице для Вашего варианта.
Б. Приведите структурную формулу и название любого представителя выбранного Вами класса соединений и составьте уравнение его реакции с данным реагентом; назовите, по какому механизму проходит эта реакция и укажите соответствующий ему символ (SR, SE, SNu, AR, AE, ANu). Укажите классы и названия продуктов этой реакции и что в ней является аналитическим сигналом.
Таблица 31 – Варианты тестовых заданий
| Вари-ант | Данный реагент | Классы органических соединений | |||
| KMnO4, pH~7 (реакция Вагнера) | алкены | ароматич. углеводороды | карбоновые кислоты | цикланы | |
| Br2, норм. условия | алканы | предельные спирты | ароматич. углеводороды | диены | |
| H2O, катализатор | алканы | алкины | спирты | фенолы | |
| Cu(OH)2, нагрев | одноатомные спирты | фенолы | кетоны | многоатомные алифатические спирты | |
| NaOH | фенолы | спирты | амины | алкены | |
| H2O, KOH, нагрев | амины | ароматич. углеводороды | предельные спирты | галогениды |
Таблица 31 – Варианты тестовых заданий
| Вари-ант | Данный реагент | Классы органических соединений | |||
| H2O, индикатор | спирты | кислоты | алкины | фенолы | |
| Br2, FeBr3 | ароматич. углеводороды | цикланы | предельные спирты | алканы | |
| NH3, нагрев | амиды | галогениды | ароматич. углеводороды | амины | |
| [Cu(NH3)2]Cl, в аммиачном растворе | алканы | алкены | алкины | ароматич. углеводороды | |
| HBr | ароматич. углеводороды | предельные карбоновые кислоты | алканы | алкены | |
| HCOOH, H+, нагрев | фенолы | спирты | кетоны | альдегиды | |
| Н2О,Н+, нагрев | сложные эфиры | цикланы | фенолы | предельные спирты | |
| C6H5NHNH2, Н+ | алканы | альдегиды | спирты | ароматич. углеводороды | |
| Na, безводная среда | спирты | алканы | алкены | простые эфиры | |
| KMnO4, pH<7, нагрев | бензол | цикланы | алканы | гомологи бензола | |
| CH3NH2 | галогенангидриды кислот | амины | алканы | простые эфиры | |
| C2H5ОH, H+, нагрев | фенолы | амины | карбоновые кислоты | гомологи бензола | |
| [Ag(NH3)2]OH, в аммиачном растворе | алкины | алканы | кетоны | алкены | |
| HCN | ароматические углеводороды | кетоны | предельные карбоновые кислоты | фенолы | |
| C2H5ОH, H+, нагрев | цикланы | спирты | фенолы | ароматические углеводороды | |
| CH3ОH, H+ | фенолы | цикланы | альдегиды | ароматические углеводороды | |
| HCl | алканы | амины | ароматические углеводороды | фенолы | |
| CH3СООH, H+, нагрев | спирты | алканы | фенолы | ароматические углеводороды |
Продолжение таблицы 31
| Вари-ант | Данный реагент | Классы органических соединений | |||
| C6H5NH2 | ароматические альдегиды | фенолы | амины | ароматические углеводороды | |
| HBr | предельные альдегиды | предельные карбоновые кислоты | спирты | предельные кетоны | |
| FeCl3 | фенолы | предельные спирты | галогениды | амины | |
| AgNO2 | нитроалканы | амины | сульфоалканы | галогениды | |
| KMnO4, pH<7, нагрев | цикланы | первичные спирты | алканы | предельные кислоты | |
| [Ag(NH3)2]OH, в аммиачном растворе | кетоны | альдегиды | спирты | фенолы |
2.16 Комплексное тестовое задание 30 по теме "Полимеры"
Рекомендуемая литература: [1, гл. 14]; [3, гл. 31, § 31.11, гл. 35]; [4, гл. 13, § 4]; лекции.
А. Из предлагаемых в Вашем варианте соединений (1, 2, 3 или 4, таблица 32) выберите мономер, который может участвовать в образовании полимера по реакции указанного в таблице типа.
Б. Объясните, по какому признаку строения выбранного соединениия Вы дали правильный ответ. Составьте схему реакции образования полимера с участием выбранного соединения; при этом, если для реакции требуется еще и другой мономер, то подберите его самостоятельно. Дайте определение реакции образования полимера в Вашем варианте. Укажите классы и названия исходного мономера (мономеров) и образующегося полимера, его элементарное звено и возможные области применения, в том числе в отрасли Вашей будущей специальности.
Таблица 32 – Варианты тестовых заданий
| Ва-ри- ант | Тип реакции образования полимера | Исходные соединения | |||
| Полимеризация | СН3(СН2)5CH2Cl | CH3CH=CHCH2Cl | СН2Cl(СН2)5CH2Cl | СН3СН2СН2CH2CH3 | |
| Поликон- денсация с другим мономером | HOOC(CH2)4COOH | H3C(CH2)4COOH | CH3CH=CHCH2CH3 | CH3CH=CHCH2COOH |
Таблица 32 – Варианты тестовых заданий
| Ва-ри- ант | Тип реакции образования полимера | Исходные соединения | |||
| Полимеризация | CH3CH2CH2CH3 | H2NCH2(CH2)3COOH | CH3CH2C≡CCH3 | H2NCH2(CH2)3NH2 | |
| Полимеризация | C6H5CH=CH2 | C6H5CH2CH3 | C6H4ClCH2CH2Cl | C6H5-C6H5 | |
| Поликон- денсация | CH3(CH2)3COOH | CH2=CH-CH=CH2 | CH2=CHCH2CH2OH | H2NCH2(CH2)3COOH | |
| Полимеризация | C6H4(COOH)2 | C6H5CH3 | CH3CH2CH2CH2CH3 | CH3CH=CH-CH=CH2 | |
| Поликон- денсация с другим мономером | H2NCH2CH2NH2 | CH3CH2CH2NH2 | CH3CH=CHCH3 | CH2=CH-CH=CH2 | |
| Поликон- денсация | НО-Si(CH3)2-CН3 | НО-Si(CH3)2-ОН | (CH3)4Si | CH2=CHCH2Cl | |
| Полимеризация | HOCH2CH2Cl | ClCH2CH2Cl | CH2=CHCl | CH3CH2Cl | |
| Поликон- денсация с другим мономером | NaO-C6H4CH3 | NaO-C6H4CH=CH2 | CH3C6H4CH3 | NaO-C6H4-ONa | |
| Полимеризация | CH2=CHOCOCH3 | CH3CH2OCOCH3 | C6H5CH2OCOCH3 | HOCH2CH2OCOCH3 | |
| Поликон- денсация с другим мономером | CH2=CH-CH=CH2 | BrCH2CH2CH2Br | BrCH2=CHCH3 | BrCH2CH2CH2CH3 | |
| Поликон- денсация | CH3C6H4OH | CH3C6H4COOH | HOCH2C6H4COOH | CH2=CHC6H4COOH | |
| Полимеризация | CH2=CClCH=CH2 | CH3CClCH2CH3 | HOCH2(CH2)2CH2OH | CH3CClCH2COOH | |
| Полимеризация | C6H5COOH | C6H5CH2COOH | C6H5CH=CH2COOH | HOOCC6H4COOH | |
| Полимеризация | CH3CH2CF=CF2 | ClCH2CH2CHFCHF2 | FCH2CH2CH2CH2F | CH3CH2CF(CH3)CHF2 | |
| Поликон- денсация | HOCH2(CH2)5COOH | HOCH2(CH2)5CH3 | CH3CH2CH=CHCOOH | CH3CH2CH=CHCl | |
| Полимеризация | HOOCCH=CHCOOH | HOOCCH2CH2COOH | CH3CH2CH2COOH | HOOC-COOH | |
| Поликон- денсация | CH3C(O)CH2C(O)CH3 | H3CC≡CCH3 | HOH2CCH=CHCH3 | HOH2CCH=CHCOOH | |
| Поликон- денсация | CH3CH2COOH | HOCH2(CH2)2CH2OH | CH2=CHCHO | CH2=CHCH2OH |
Продолжение таблицы 32
| Ва-ри- ант | Тип реакции образования полимера | Исходные соединения | |||
| Поликон- денсация с другим мономером | CH3OCH3 | HCOOH | H2N(CH2)2NH2 | CH2=CHCOOH | |
| Полимеризация | C6H5OH | C2H5OC2H5 | CH3COCH3 | CH2=CHCONH2 | |
| Поликон- денсация | HOC6H12OH | C6H5CH3 | C6H5CH=CH2 | C6H6 | |
| Поликон- денсация | HOCH2C6H4CH3 | HOCH2C6H4CH2OH | HOCH2C6H4CH=CH2 | HOC6H4OH | |
| Полимеризация | CH3CH=CHCOOCH3 | CH3CH2CH2COOCH3 | C6H5COOCH3 | HOC6H4COOH | |
| Поликон- денсация | CH3CH2CN | CH2=CHCN | H2NCH2CH2NO2 | HOCH2CH2COOH | |
| Полимеризация | C6H5CN | HOCH2CH2CN | CH3CH2CN | CH2=CHCN | |
| Полимеризация | HOCH2CH=CHCH3 | HOCH2CH2CHOHCH3 | HOC6H4OH | HOOC-COOH | |
| Поликон- денсация с другим мономером | HOOC(CH2)2CH2NO2 | HOOC(CH2)2COOH | CH3(CH2)2COOH | CH3CH=CHCOOH | |
| Полимеризация | C6H5COOH | CH2ClCH2COOH | CH2=CHOCH3 | CH3CH2COOH |
Список рекомендуемой литературы
1. Коровин Н.В. Общая химия. – М.: Высшая школа, 2010 и др. годы изд.
2. Гельфман М.И., Юстратов В.П. Химия. – СПБ.: Лань, 2008 и др. годы изд.
3. Глинка Н.Л. Общая химия. – М.: Юрайт, 2010; М.: Интеграл-пресс, 2009 и др. годы изд.
4. Денисов В.В., Дрововозова Т.И., Лозановская И.Н. Химия. – М.; Ростов-н/Д: Издат. центр. "Март Т", 2003 и др. годы изд.
5. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 2009 и др. годы изд.
Приложение А
(обязательное)
Ответы на тестовые задания
Номера правильных ответов приведены в двух таблицах А.1 и А.2 в клетках, образованных пересечением номера Вашего варианта (от 1 до 30) и номера тестового задания.
Таблица А.1 – Ответы на тестовые задания 1–16
| Ва- ри- ант | Номера тестовых заданий | ||||||||||||||||||||||||||
| Правильные ответы | |||||||||||||||||||||||||||
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!