
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбція
|
|
|
|
Зливними пристроями.
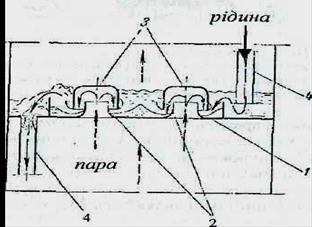
Рис. 11. Схема роботи
ковпачкової тарілки:
1-тарілка,
2-газові патрубки,
3-ковпачки,
4-зливні труби.
За допомогою абсорбційних колон забруднений газ очищується і викидається в атмосферу. У результаті абсорбції утворюється розчин окремих газів в абсорбенті або розчин певного продукту у випадку хемосорбції. Відпрацьований абсорбент необхідно регенерувати, тобто виділити з нього розчинений газ або утворений продукт. Це здійснюють з використанням зниження тиску над абсорбентом, підвищенням температури. Процес називають десорбцією. У результаті розчинені гази чи продукти видаляють для подальшої переробки або використання, а очищений абсорбент повертається в цикл на абсорбцію.
Адсорбція - процес поглинання одного або декількох компонентів газової суміші твердою речовиною - адсорбентом. Компонент, що поглинається називається адсорбатом або адсорбтивом. Зворотний процес - виділення газу з твердої речовини називають десорбцією. Адсорбцію поділяють на фізичну і хімічну (хемосорбція).
Фізична адсорбція викликана взаємним притяганням молекул адсорбату й адсорбенту під дією сил Ван-дер-Ваальса.
Хімічна адсорбція супроводжується хімічною реакцією між складовими газової суміші з адсорбентом з утворення хімічних зв'язків. Різновидністю фізичної адсорбції є заповнення пор адсорбенту рідиною, що утворюється в результаті конденсації парів. Її називають капілярною конденсацією.
В якості адсорбентів використовують пористі тверді речовини з великою питомою поверхнею. Питома поверхня - це площа поверхні всіх частинок одиниці маси адсорбенту.
Адсорбенти мають різні за діаметром капілярні канали-пори, які поділяють на: макропори (більше 2*10-4мм), перехідні пори (6*10-4-2*10-4 мм), мікропори (2*10-6-6*10-6 мм). Від розміру пор залежить характер адсорбції.
Макропори значно більші за розміри молекул газів, тому на їх стінках адсорбується дуже мала кількість молекул газу. Вони в основному грають роль транспортних каналів для газу. На поверхні перехідних пор утворюються шари поглиненої речовини. Можливе утворення шарів товщиною в одну молекулу (мономолекулярна адсорбція) або в декілька молекул (полімолекулярна адсорбція). Розміри мікропор наближаються до розмірів адсорбованих молекул і адсорбція в мікропорах приводить до заповнення їх об'єму.
Адсорбенти характеризуються своєю поглинальною або адсорбційною здатністю: масою адсорбату поглинутого одиницею маси чи об'єму адсорбенту. Ця здатність залежить від температури, тиску газу і від концентрації поглинаючої речовини в газі. Максимально можливу при даних умовах адсорбційна здатність називають рівноважною активністю.
Промисловість використовує самі різноманітні адсорбенти природного і штучного походження. Серед них: активоване вугілля, силікагелі, цеоліти та інші. Активоване вугілля одержують шляхом термічної обробки різних карбоновмісних речовин (дерево, кості...) і видаленням смолистих речовин, а також введенням активаторів (цинк хлориду, кислот, лугів та ін.). Питома поверхня активованого вугілля 800-1700 м/г. Воно добре поглинає пару органічних речовин, сульфур діоксид та інші гази.
Силікагелі являють собою продукти обезводнення гелю силікатної кислоти. Вони використовуються в основному для осушення газів. Цеоліти - синтетичні або природні мінерали - алюмосилікати, що мають переважно мікропори. Їх поглинаюча здатність дуже велика, тому їх широко використовують не тільки для процесів очищення, але й для процесів розділення сумішей на окремі компоненти. Процес адсорбції залежить від температури процесу, концентрації газу, характеру процесу: періодичний, безперервний. Спрощена модель періодичного процесу адсорбції розроблена Шиловим Н.А. Якщо в шар чистого адсорбенту буде безперервно поступати неочищений газ, то поглинання адсорбату проходить в основному на початку шару адсорбенту (лобова або фронтальна ділянка). Подальші шари в процесі участі не беруть. Через деякий час даний шар стає насиченим за відношенням до адсорбату і неочищений газ «проскакує» на слідуючий шар і т.д.
Час роботи шару до насичення його лобової ділянки називають періодом формування фронту адсорбції.
У практиці розрахунків адсорбційних процесів користуються величиною динамічної активності адсорбенту. Це величина, що виражається кількістю поглинутої речовини за проміжок часу від початку поглинання до «проскоку». Цей час називають часом захисної дії адсорбенту, визначається за емпіричним рівнянням Шилова Н.А.
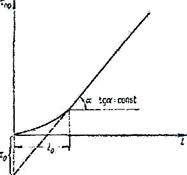
|
Як видно на рис. 12, залежність часу захисної дії від довжини шару адсорбенту в період формування фронту виражається плавною кривою, яка в період паралельного переносу фронту адсорбції переростає в пряму лінію.
| Рис. 12 Залежність часу захисної дії від довжини шару адсорбенту |
Другою стадією адсорбційної очистки газів є регенерація відпрацьованого адсорбенту - десорбція. До числа основних методів десорбції відносять:
- витіснення з адсорбенту поглинених компонентів з використанням агентів, що мають більш високу адсорбційну здатність, ніж поглинені компоненти;
- випаровування поглинених компонентів шляхом нагріву шару
адсорбенту;
- промивку адсорбенту розчинниками адсорбату.
На практиці десорбцію здійснюють шляхом пропускання пари чи газу, що не вміщує адсорбату, через шар адсорбенту.
До атмосфери надходить велика кількість пилу, газів, металів та їх окислів, різних органічних речовин. В результаті забруднення атмосфери у ряді міст утворюється „смог”. Для захисту атмосфери від забруднення застосовуються різноманітні методи. Домінуючим є очистка газів від твердих часток. Не менш важливим є також очистка повітря від таких газів, як СО, NO, NO2, HCN, H2S та ін.
Є декілька методів каталітичного перетворення домішок при очистці газових викидів:
1. Окислення домішок (вуглеводнів, спиртів, а також інших органічних речовин та окисли вуглеводу) до нешкідливих продуктів – СО2 та Н2О.
2. Окислення домішок (хлорорганічних речовин, окислів азоту, серністого газу) до необхідних продуктів (СІ2, HNO3, H2SO4).
3. Відновлення домішок до нешкідливих продуктів (наприклад, NO в N2).
4. Відновлення домішок до необхідних продуктів (наприклад, SO2 в S).
5. Розкладання домішок до нешкідливих продуктів.
Розглянемо, наприклад, очистку повітря від сірководню – сильної нервово–токсичної отрути. Найбільш розповсюджений метод окислення H2S. Спочатку сірководень перехоплюється будь-яким абсорбентом (водні розчини Na2CO3, K2CO3, NH3, Fe(OH)3 та інші), а потім поглинений H2S каталітично окислюють киснем повітря з утворенням елементарної сірки:
2H2S + О2 → 2Н2О + 2 S
Головним недоліком цього методу є відносно низький ступень очистки від H2S (50 – 60%) та утворення в багатьох випадках речовин типу ціаністих, які сильніші за отруйними властивостями ніж сам сірководень.
Більш широке застосування знайшов метод Клауса, який також засновано на окисленні H2S киснем повітря до сірки. Окислення проводять у дві стадії: термічної та каталітичної. У термічній стадії ведуть полум’яне окислення H2S стехіометричними кількостями кисню при температурах 300 – 13500С. При цьому частина H2S окислюється до SО2. У каталітичній стадії йде реакція між H2S та SО2 на таких каталізаторах, як боксид або окись алюмінію, при температурі 220 – 2500С.
Головний прогрес в зменшені відходів серністого ангідриду до атмосфери набув за рахунок розробки та впровадження принципово нового способу отримання сірчаної кислоти методом каталітичного рідиннофазного окислення сірнистого газу при підвищених температурах, які дозволяють довести ступінь перехоплення SО2 до 100%:
2SО2 + О2 + 2Н2О → 2Н2 SО4
Важливою особливістю нового методу є можливість використання як бідних газів теплових станцій та підприємств чорної металургії, які містять 0,1 – 1,0% серністого газу, так і концентрованого (майже до 100%) серністого ангідриду. Новий метод отримання сірчаної кислоти повністю відокремлює шкідливі впливи на біосферу.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2156; Нарушение авторских прав?; Мы поможем в написании вашей работы!