
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Простых и сложных веществ. Закон эквивалентов
|
|
|
|
Моль. Эквиваленты и эквивалентные массы
Дополнительная
Основная
Органические полимеры.
Получение полимеров. Реакции полимеризации. Полиэтилен, полипропилен, поливинилхлорид, полистирол. Реакции поликонденсации. Фенолформальдегидные смолы, карбамидоформальдегидные смолы, эпоксидные смолы, фурановые смолы. Кремнийорганические полимеры. Битумы и дегти.
Физико-химические свойства полимеров. Особенности внутреннего строения полимеров. Пластические массы и полимербетоны, заполненные полимеры, наполнители, добавки к бетонам. Полимерные покрытия и клеи. Способы переработки пластических масс и получения элементов строительных конструкций.
Стойкость и старение различных полимерных материалов в условиях длительной эксплуатации. Физиологическая активность полимерных материалов.
ЛИТЕРАТУРА
Лучинскмй Г.П. Курс химии. — М.: Высшая школа, 1985.
Курс общей химии/ Под ред. Н.В. Коровина. — М.: Высшая школа, 1981.
Глинка Н.Л. Общая химия. - Л.: Химия, 1977-1983.
Введение в общую химию/ Под ред. Г.П. Лучинского. — М.: Высшая школа, 1980.
Фролов В.В. Химия. - М.: Высшая школа, 1979.
Харин А.Н.. Катаева Н.А., Харина Л.Т. Курс химии. - М.: Высшая школа, 1983.
Курс химии. Ч. 2, специальная для строительных вузов/ Под ред. В.Киреева.— М.; Высшая школа, 1974.
Левант Г.Е. и Райцын Г.А. Практикум по общей химии. - М.: Высшая школа, 1978.
Павлов Н.Н. Теоретические основы общей химии. - М.: Высшая школа. 1978.
Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии. – М.:Химия, 1979.
Глинка Н.Л. Задачи и упражнения по общей химии. - Л.: Химия, 1985.
Гольбрайх З.Е. Сборник задач и упражнений по химии, - М.: Высшая школа, 1984.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 86594. две последние цифры 94. им соответствует вариант контрольного задания 94.
КОНТРОЛЬНОЕ ЗАДАНИЕ
С 1 января 1963 г. в СССР введена Международная система единиц измерения (СИ). состоящая из шести основных единиц: метр (м) - длина, килограмм (кг) -масса, секунда (с) - время, ампер (А) - сила тока, кельвин (К) - термодинамическая температура, кандела (кд) - сила света. XIV Генеральная конференция по мерам и весам (1971) утвердила в качестве седьмой основной единицы Международной системы моль (моль) - единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц. Моль вещества соответствует постоянной Авогадро NА= (6.022045 ± 0,000031) •1023 моль-1 структурных элементов. При применении понятия "моль" следует указывать, какие структурные элементы имеются в виду, например моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т.п. Так, заряд моля электронов равен 6,022•1023еи отвечает количеству электричества, равному 1 фараде (F). Масса моля атомов или масса моля молекул (мольная или молярная масса). выраженная в граммах (г/моль), есть грамм-атом данного элемента или соответственно грамм-молекула данного вещества в прежнем понимании.
Пример 1. Выразите в молях: а) 6,02•1021 молекул СО2; б) 1.20•1024 атомов кислорода; в) 2,00•1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль - это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02•1023). Отсюда а) 6,02•1021. т.е. 0.01 моль; б) 1,20 • 1024, т.е. 2 моль; в) 2,00•1023, т.е. 1/3 моль.
Масса моли вещества выражается в кг/моль, или г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу тэ азота, серы и хлора в соединениях NH3, H2S и HCI.
Решение. Масса вещества и количество вещества - понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества - в молях.
Эквивалент элемента (Э) - это такое количество вещества, которое соединяете с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой (тэ). Таким образом, эквиваленты выражаются в молях, а эквивалентные массы - в г/моль.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(Сl) = 1 моль. Исходя из мольных масс этих элементов, определяем их эквивалентные массы:mЭ(N)=1/3•14=4,67 г/моль; тэ (s) =1/2•32 =16 г/моль; тЭ(Сl) = 1• 35,45=35,45 г/моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2.24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013 *105 Па (760 мм рт. ст. =1 атм), температура 273 К или 0°С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m2 и m2 пропорциональны их эквивалентным массам (объемам):
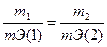 (1)
(1)
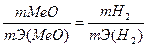 (2)
(2)
Если одно из веществ находится в газообразном состоянии, то, как правило его количество измеряется в объемных единицах (см3, л, м3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода V/mЭ(H2). молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4: 2 =11,2 л. В формуле (2) отношение mH2\mЭ(н2) заменяет равным ему отношением VH2\VmЭ(H2) где VH2 -объем водорода. VmЭ(H2) эквивалентный объем водорода:
 (3)
(3)
Из уравнения (3) находим эквивалентную массу оксида металла mЭ(МвО).
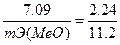 ,
, 
Согласно закону эквивалентов mЭ(МеО) = mЭ(Ме) + mЭ(О2) отсюда mЭ(Ме) = mЭ(МеО) – mЭ(О2) = 35.45 - 8 = 27,45 г/моль. Мольная масса металла определяется из соотношения mЭ = А/В, где тЭ — эквивалентная масса, A — мольная масса металла. B — стехиометрическая валентность элемента; А = mЭВ = 27,45* 2 =54,9 г/моль. Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как мольная (молярная) масса О2 (32 г/моль) при н.у. занимает объем 22,4 м3, то объем эквивалентной массы кислорода (8 г/моль) будет 22,4: 4 =5.6 л. =5600 см3. По закону эквивалентов
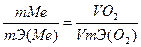 или
или 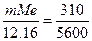
Откуда 
Пример 5. Вычислите эквиваленты и эквивалентные массы H2S04 и А!(ОН)з в реакциях, выраженных уравнениями:
H2SO4 + КОН = KHSO4 + Н2О (1)
H2SO4 + Mg = MgSO4 + Н2 (2)
Al(OH)3+ HCl = Al(OH)2Cl+ Н2О (3)
Аl(ОН)3+ЗНNО3 = Аl(NО3)3+ЗН2О (4)
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основания) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса H2SO4 в реакции (1) MH2SO4= 98 г/моль, а в реакции (2) MH2SO4/2 = 49 г/моль. Эквивалентная масса Al(ОН)з в реакции (3) M Al(OH)3 = 78 г/моль, а в реакции (4) M Al(OH)3/3 = 26 г/моль.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной эквивалентной массой КОН и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) М/1 г/моль и в реакции (2) М/2 г/моль. А1(ОН)3 взаимодействует с одной эквивалентной массой HCl и тремя эквивалентными массами НNО3, поэтому его эквивалентная масса в реакции (3) равна M/1 г/моль, в реакции (4) M/З г/моль. Эквиваленты H2SO4 в уравнениях (1) и (2) соответственно равны 1 моль и 1/2 моль; эквиваленты Al(OH)3 в уравнениях (3) и (4) соответственно равны 1 моль и 1/3 моль.
Пример 6. Из 3.85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (mЭ(Ме)).
Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксильной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера в уравнении примера (3)

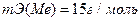
Пример 7. В какой массе Са (ОН) 2 содержится столько же эквивалентов, сколько в312г А1(ОН)3?
Решение. Эквивалентная масса Al(ОН)3 равна 1/3 его мольной массы, т.е. 78/3 = 26 г/моль. Следовательно, в 312 г А1(ОН)3 содержится 312/26 =12 эквивалентов. Эквивалентная масса Сa(ОН)2 равна 1/2 его мольной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль * 12 моль = 444г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Мольная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02*1023) =1,63* 10-22 г.
Контрольные вопросы
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РН3, Н2О, НВг.
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100 г.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Ответ: 32, 5 г/моль.
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Ответ: 9 г/моль.
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1.017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32, 68 г/моль.
7. Выразите в молях: а) 6,02 • 1022 молекул C2H2; б) 1,80 • 1024 атомов азота; в)
3,01 • 1023 молекул NH3. Какова мольная масса указанных веществ?
8. Вычислите эквивалент и эквивалентную массу Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла?
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла.
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла. Ответ 103,6 г/моль.
12. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fe(OH)3 в каждой из этих реакций.
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.
14. В каком количестве Сr(ОН)3 содержится столько же эквивалентов, сколько -в 174,96 г Mg(OH)2? Ответ: 174г.
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы а) гидрокарбоната кальция; 6} дихлорида гидроксоалюминия. Напишите уравнения.
реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная у массы металла?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла.
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0 • 10-23 г, 3,0 • 10-23 г.
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 49 г/моль, 2.
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 41 г/моль, 2.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1001; Нарушение авторских прав?; Мы поможем в написании вашей работы!