
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое сродство
|
|
|
|
При решении задач этого раздела см. табл. 5-7.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но, и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации). к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая - с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя анергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству. S, U. H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п., - ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение (DS) зависит только от начального (S1 и конечного S2) состояния и не зависит от пути процесса:

DS=S2-S1. Если S2> S1, то DS >0. Если S2< S1, то DS <0.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка TDS. Энтропия выражается в Дж/ (моль • К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую сипу процесса, которую обозначают DG, можно найти из соотношения


Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. И так, мерой химического сродства является убыль энергии Гиббса (DG), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
 (3)
(3)
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и. в частности, в сторону уменьшения DG. Если DG < 0, процесс принципиально осуществим; если DG >0, процесс самопроизвольно проходить не может. Чем меньше DG. тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором DG =0 и DH= TDS.
Из соотношения DG = DH - TDS.видно, что самопроизвольно могут протекать и процессы, для которых DH > 0 (эндотермические). Это возможно, когда DS > О, но |TDS| > |DH|, и тогда DG < 0. С другой стороны, экзотермические реакции (DH < 0) самопроизвольно не протекают, если при DS < 0 окажется, что DG > G.
Таблица 6. Стандартная энергия Гиббса образования
DG°298 некоторых веществ
| Вещество | Состояние | DG°298 кДж/моль | Вещество | Состояние | DG°298 кДж/моль |
| ВaСO3 | к | -1138.8 | FeO | к | -244.3 |
| СaСО3 | к | -1128,76 | Н2O | ж | -237.19 |
| Fe3O4 | к | -1014.2 | Н2O | г | -228,89 |
| ВеСО3 | к | -944,75 | РbО2 | к | -219.0 |
| CaO | к | -604.2 | СО | г | -137,27 |
| BaO | к | -581.61 | СН4 | г | -50.79 |
| ВеО | к | -628.4 | NO2 | г | +51.84 |
| CO2 | г | -394,38 | NO | г | +86.69 |
| NaCl | к | -384.03 | С2Н2 | г | +209.20 |
| ZnO | к | -318.2 |
Пример 1. В каком состоянии энтропия 1 моль веществе больше: кристаллическом или парообразном при той же температуре?
Решение: Энтропия есть мера неупорядоченности состояния вещества. В кристаллах частицы (атомы, ионы) расположены упорядочение и могут находиться лишь в определенных точках пространства, а для rasa таких ограничений шаг. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества; возможность хаотичного, движения молекул газа больше. А так как энтропию можно рассматривать как
количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристалов при одинаковой температуре
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
СН4 (г) + CO2 (г) ↔ 2CO (г) + 2Н2 (г)
Решение. Для ответа на вопрос следует вычислить DG°298 до прямой реакции. Значения DG°298 соответствующих веществ приведены в табл. 6. Зная, что DG°298 есть функция состояния и что DG°298 для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим DG°298 процесса:
DG°298 = 2 (-137.27) + 2 (0) - (-50,79 - 394,38) = + 170,63 кДж.
То что DG°298 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 1,013 -10s Па (760 мм рт. ст. = 1 атм).
Таблица 7. Стандартные абсолютные энтропии 5298
некоторых веществ
| Вещество | Состояние | DS°298 Дж/ (моль • К) | Вещество | Состояние | DS°298 Дж/ (моль • К) |
| С | Алмаз | 2.44 | Н20 | г | 188,72 |
| С | Графит | 5.69 | N2 | г | 191,49 |
| Fe | к | 27.2 | NH3 | г | 192.50 |
| Ti | к | 30.7 | СО | г | 197.91 |
| S | Ромб | 31,9 | С2Н2 | г | 200.82 |
| ТiO2 | к | 50.3 | 02 | г | 205.03 |
| FeO | к | 54.0 | H2S | г | 205.64 |
| H2O | ж | 69,94 | N0 | г | 210.20 |
| Fe2O3 | к | 89.96 | С02 | г | 213.65 |
| NH4CI | к | 94,5 | С2Н4 | г | 219.45 |
| CH3OH | ж | 126,8 | CI2 | г | 222,95 |
| H2 | г | 130.59 | N02 | г | 240,46 |
| Fe3O4 | к | 146,4 | Р03 | г | 311,66 |
| CH4 | г | 186.19 | РС1$ | г | 352,71 |
| HCI | г | 186,68 |
Пример 3. На основании стандартных теплот образования - (табл. 5) и абсолютных стандартных энтропии веществ (табл. 7) вычислите DG°298 до реакции протекающей по уравнению
СО (г) + Н2О(ж) =СО2 (г) + Н2 (г)
Решение:DG° = DH° - TDS°; DНи DS - функции состояния, поэтому
 ,
, 
DH°х.р. = (-393.51 + 0) - (-110.52 - 285,84) =+2,85 кДж;
 =(213,65 + 130,59)- (197,91 + 69,94)= + 76,39 = 0,07639 кДж/ (моль • К);
=(213,65 + 130,59)- (197,91 + 69,94)= + 76,39 = 0,07639 кДж/ (моль • К);
 = +2,85 - 298 • 0,07639 = -19,91 к Дж.
= +2,85 - 298 • 0,07639 = -19,91 к Дж.
Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению
Fe2O3(к) + ЗН2(г)=2Fe(к) + ЗН20(г);  = +96,61 к Дж.
= +96,61 к Дж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии  S = =0,1387 кДж/ (моль • К)? При какой температуре начнется восстановление Fe203?
S = =0,1387 кДж/ (моль • К)? При какой температуре начнется восстановление Fe203?
Решение. Вычисляем  реакции:
реакции:
 G=
G=  Н- T
Н- T S = 96,61 - 298 • 0.1387 = +55.28 кДж.
S = 96,61 - 298 • 0.1387 = +55.28 кДж.
Так как  G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой  G = 0:
G = 0:

Следовательно, при температуре  696,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите  Н,
Н,  S и
S и  реакции, протекающей по уравнению
реакции, протекающей по уравнению
Fe2O3 (к) + ЗС = 2Fe + ЗСО
Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К?
Решение:  и
и  находим из соотношений (1) и (2) так же, как в примере 3:
находим из соотношений (1) и (2) так же, как в примере 3:
 =
= = -331.56 + 822,10 = +490.54 кДж;
= -331.56 + 822,10 = +490.54 кДж;
 = (2 • 27.2 + 3 • 197.91)- (89.96+ 3- 5,69) = 541,1 Дж/К.
= (2 • 27.2 + 3 • 197.91)- (89.96+ 3- 5,69) = 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения  =
= Н° - T
Н° - T S:
S:
 G500 = 490.54 - 500
G500 = 490.54 - 500 = + 219.99 кДж
= + 219.99 кДж
 G1000 = 490.54 - 1000
G1000 = 490.54 - 1000  = - 50.56кДж
= - 50.56кДж
Так как  G500 > 0, a
G500 > 0, a  G1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
G1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
Контрольные вопросы
101. Вычислите  G0298 для следующих реакций:
G0298 для следующих реакций:
а) 2NаF (к) + Cl2 (г) =2NaCl (к) + F2 (г)
б) РbО2 (K)+ 2Zn (к) = Рb (к) + 2ZnO (к)
Можно лм получить фтор по реакции (а) и восстановить РbO2 цинком по реакции
(б)? Ответ: + 313,94 кДж; -417,4 кДж.
102. При какой температуре наступит равновесие системы
4HCl (г) + 02 (г) 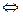 2Н2O (г) + 2Сl2 (г);
2Н2O (г) + 2Сl2 (г);  Н = -114,42 кДж?
Н = -114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К.
103. Восстановление Fe304 оксидом углерода идет по уравнению
Fe304 (к) + СО (г) = 3FeO (к) + С02 (г)
Вычислите 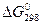 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно  в этом процессе? Ответ: +24,19 кДж; +31,34 Дж/(мoль • К).
в этом процессе? Ответ: +24,19 кДж; +31,34 Дж/(мoль • К).
104. Реакция горения ацетилена идет по уравнению
С2Н2 (г)+ 5/202 (г)=2СО2 (г) + Н20 (ж)
Вычислите 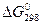 и
и .Объясните уменьшение энтропии в результате этой
.Объясните уменьшение энтропии в результате этой
реакции. Ответ: -1235,15 кДж; -216,15 Дж/(мoль • К).
105. Уменьшается или увеличивается энтропия при переходах: а) воды в пар;
б) графита в алмаз? Почему? Вычислите  Для каждого превращения. Сделайте
Для каждого превращения. Сделайте
вывод о количественном изменении энтропии при фазовых и аллотропических пре
вращениях.
Ответ: а) 118,78 Дж/ (моль • К); б) -3,25 Дж/ (моль • К).
106. Чем можно объяснить что при стандартных условиях невозможна экзотермическая реакция?
Н2 (г) + С02 (г) =СО (г) + Н20 (ж);  Н = -2,85 кДж?
Н = -2,85 кДж?
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите 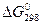 этой реакции. Ответ: +19,91 кДж.
этой реакции. Ответ: +19,91 кДж.
107. Прямая или обратная реакция будет протекать при стандартных условиях
в системе
2NO(г) + 02(г) 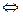 2N02(г)
2N02(г)
Ответ мотивируйте, вычислив 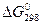 прямой реакции. Ответ: -69,70 кДж.
прямой реакции. Ответ: -69,70 кДж.
108. Исходя из значений стандартных теплот образования и абсолютных стандарт-
ных энтропий соответствующих веществ, вычислите 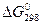 реакции, протекающей по
реакции, протекающей по
уравнению
NH3(г) + HCl(г) = NH4Cl(к)
Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ: -92,08 кДж.
109. При какой температуре наступит равновесие системы
СО (г) + 2Н2 (г) 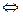 СН3ОН (ж);
СН3ОН (ж);  Н = -128,05 кДж?
Н = -128,05 кДж?
Ответ.  385,5 К.
385,5 К.
110. При какой температуре наступит равновесие системы
СН4 (г) + CO2(г) = 2СО(г) + 2H2 (г):  = + 247,37 кДж?
= + 247,37 кДж?
Ответ:  961,9 К.
961,9 К.
111. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 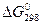 реакции, протекающей по уравнению
реакции, протекающей по уравнению
4 NH3 (г) + 502 (г) =4NO (г) + 6Н20 (г)
Возможна ли эта реакция при стандартных условиях? Ответ: -957,77 кДж
112. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 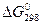 реакции, протекающей по уравнению
реакции, протекающей по уравнению
CO2 (г) + 4Н2 (г) = СН4 (г) + 2Н20 (ж)
возможна ли эта реакция при стандартных условиях? Ответ: —130,89 кДж.
113. Вычислите 
 Н,
Н,  S и
S и  -реакции, протекающей па уравнению
-реакции, протекающей па уравнению
Fe2О3 (к) + ЗН2 (г) =2Fe (к) + ЗН20 (г)
Возможна ли реакция восстановления Fe2О3 водородом при температурах 500 и 2000 К?
Ответ: + 96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,05 кДж.
114. Какие из карбонатов: ВеСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив 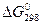 реакций. Ответ: + 31,24 кДж; -130,17 кДж; -216,02 кДж.
реакций. Ответ: + 31,24 кДж; -130,17 кДж; -216,02 кДж.
115. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 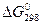 реакций, протекающих по уравнению
реакций, протекающих по уравнению
СО (г) + ЗН2 (г) = СН4 (г) + Н20 (г)
Возможна ли эта реакция при стандартных условиях? Ответ: -142,16 кДж.
116. Вычислите 
 Н,
Н,  S и
S и  -реакции, протекающей по уравнению
-реакции, протекающей по уравнению
ТiO2 (к) + 2С (к) = Ti (к) + 2СО (г)
Возможна ли реакция восстановления TiO2 углеродом при температурах 1000 и 3000 К? Ответ: +722,86 кДж; 364,84 Дж/К; +358,02 кДж; -371,66 кДж.
117. На основании стандартных теплот образования и абсолютных стандартных
энтропий соответствующих веществ вычислите 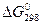 реакции, протекающей по
реакции, протекающей по
уравнению
C2Н4 (г) + ЗО2 (г) =2С02 (г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях? Ответ: -1331,21 кДж.
118. Определите, при какой температуре начнется реакция восстановления Fe304,
протекающая по уравнению
Fe3О4 (к) + СО (г) = 3FeO (к) + С02 (г);  Н = + 34,55 кДж. Ответ: 1102,4 К.
Н = + 34,55 кДж. Ответ: 1102,4 К.
119. Вычислите, при какой температуре начнется диссоциация пентахлорида
фосфора, протекающая по уравнению
РС15 (г) = PСl3 (г) + Cl2(г);  = +92,59 кДж.
= +92,59 кДж.
Ответ: 509 К.
120. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4(г) = С2Н2(г) + ЗН2(г)
N2(г) + 3H2(г) = 2NH3(г)
С (графит) + 02 (г) = С02 (г)
Почему в этих реакциях  > 0; <0;
> 0; <0; 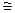 0? Ответ: 220,21 Дж/К; -198,26 Дж/К; 2,93 Дж/К.
0? Ответ: 220,21 Дж/К; -198,26 Дж/К; 2,93 Дж/К.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1360; Нарушение авторских прав?; Мы поможем в написании вашей работы!