
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома. Пример 1. Что такое квантовые числа?
|
|
|
|
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0.9-0,95 %) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml ). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n). форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами (n,l,m1,mS). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) - момент количества движения (энергетический подуровень), число m l (магнитное) - магнитный момент, mS - спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами ( ). В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
). В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
| Таблица 1. Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях | ||||||||||||||
| Квантовый | Магнитное квантовое число m l | |||||||||||||
| уровень | подуровень | Число квантовых состояний | Максимальное число электронов | |||||||||||
| обозначение | главное квантовое число n | обозначение | орбитальное квантовое число l | в подуровне (2 l +1) | В уровне n2 | В подуровне 2(2 l +1) | в уровне 2n2 | |||||||
| К | s | |||||||||||||
| L | s | |||||||||||||
| p | -1 | +1 | ||||||||||||
| М | s | |||||||||||||
| p | -1 | +1 | +2 | |||||||||||
| d | -2 | -1 | +1 | |||||||||||
| N | s | |||||||||||||
| p | -1 | +1 | ||||||||||||
| d | -2 | -1 | +1 | +2 | ||||||||||
| | f | -3 | -2 | -1 | -1 | +2 | +3 |

Рис. 1. Формы s-, p- d- электронных облаков (орбиталей)
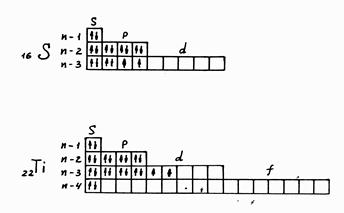
Пример 2. Составьте электронные формулы атомов элементов порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где п - главное квантовое число. l -орбитальное квантовое число (вместо наго указывают соответствующее буквенное обозначение – s,p,d,f), x - число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией - меньшая сумма n+ l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая.
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→
(6dl-2) →5f→6d→7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формулы имеют вид
16S 1s 2 2s 2 2р 6 3s2Зр4
22Ti 1s22s22р63s23p63d24s2
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей АО. Квантовую ячейку обозначают в виде прямоугольника □, кружка ○ или линейки , а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами 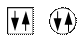
 или
или 
 . В данном пособии применяют прямоугольники. Обитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
. В данном пособии применяют прямоугольники. Обитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
Пример 3. Изотоп 101-го элементе - менделевия (256) был получен бомбардировкой α-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение: Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращения атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением
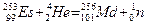
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид:253Es(α, n)256Md. В скобках на первом месте пишут бомбардирующую частицу, а на втором, через запятую. - частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы  ;
; 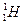 ;
; ;
;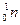 обозначают соответственно α, p. d. n.
обозначают соответственно α, p. d. n.
Пример 4. Исходя из сокращенных уравнений ядерных реакций (табл. 2). напишите их полные уравнения.
Решение:. Ответ на вопрос отражен в табл. 2.
Таблица 2. Сокращенные и полные уравнения ядерных реакций
| Сокращенные уравнения | Полные уравнения |


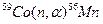
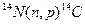
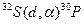
| 


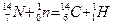
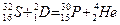
|
Контрольные вопросы
21. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
22. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
23. Какое максимальное число электронов могут занимать s-, p -. d- и f- обитали. данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером.
24. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
25. Какие орбитами атома заполняются электронами раньше: 4s или 3d; 5s или 4р. Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
26. Изотоп никеля-57 образуется при бомбардировке ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
27. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
28. Что такое изотоп? Можно объяснить что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
29. Изотоп кремния 40 образуется при бомбардировке a-частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
30. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d- орбиталей у атомов последнего элемента
31. Изотоп углерода-11 образуется при бомбардировке прогонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
32. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин р- электронов у атомов первого и f-электронов у атомов второго элемента?
33. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d- орбиталей в атомах этих элементов?
34. Сколько и какие значения может принимать магнитное квантовое число m l при орбитальном числе l = 0,1,2 и 3? Какие элементы в периодической системе называют S-, p-. d- и f- элементами? Приведите примеры.
35. Какие значения могут принимать квантовые числа n, l, m l,ms характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния?
З6. Какие из электронных формул, отражающих строение не возбужденного атома некоторого элемента неверны: a) 1s22s22p53s1; б) 1s22s22p6.в) 1s22s22р63s2Зр63d4. г) 1s22s22p63s23p64s2; д) 1s22s22рбЗs2:Зd2? Почему? Атомам, каких элементов отвечают правильно составленные электронные формулы?
37. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит "провал" одного 4s-электрона на 3d -подуровень. Чему равен максимальный спин d-электронов у атомов первого и р- электронов у атомов второго элементов?
38. Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n=4; l =0; ml=0; ms=±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных Зd-орбиталей он содержит.
39. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
40. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42. учитывая, что у последнего происходит "провал" одного 5s-электрона на 4d - подуровень. К какому электронному семейству относится, каждый из этих элементов?
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 2361; Нарушение авторских прав?; Мы поможем в написании вашей работы!